신장종괴의 초음파 진단
Abstract
Ultrasonography is commonly used in the diagnosis and management of kidney-related disease. Most of the renal masses are found incidentally by ultrasound, computed tomography or magnetic resonance imaging. The renal mass is divided into a cystic mass and a solid mass according to the nature of the mass. The renal mass is also divided into malignant and benign mass. This review demonstrates the characteristic of renal mass based on ultrasound imaging.
Keywords: Ultrasonography; Kidney; Diagnosis
중심 단어: 초음파; 신장; 진단
서 론
신장종괴의 대부분은 초음파, computed tomography (CT) 또는 magnetic resonance imaging을 시행 중 우연히 발견된다. 그래서 대부분의 신장종괴는 무증상인 경우가 많다.
신장종괴는 종괴의 성상에 따라 낭성종괴와 고형종괴로 나뉜다. 낭성종괴의 대부분은 단순신낭종(simple cyst)이다. 복합신낭종(complicated cyst)은 악성화 가능성이 있으며 다낭성 신질환(polycystic kidney disease)은 유전성 질환과 관련이 있다. 고형종괴는 다시 악성 종괴와 양성 종괴로 나누어진다. 악성 신장종괴의 90%는 신세포암(renal cell carcinoma)이며 양성 종괴는 혈관근지방종(angiomyolipoma)이 가장 흔하다. 해부학적 변이로 인하여 관찰되는 가성종양에는 두꺼운 신장기둥(prominent column of bertin)과 낙타혹(dromedary hump)이 있다. 본고에서는 각종 신장종괴의 복부 초음파 상의 특징을 사진과 함께 정리하였다.
본 론
신장의 초음파 소견
성인에서 신장의 크기는 일반적으로 10-12 cm이며 피질의 두께는 7-10 mm이고 수질은 1.5-2 cm 크기로 관찰된다. 하지만 이러한 크기와 두께는 신체 크기에 따라 달라진다( Fig. 1) [ 1, 2]. 신장의 피질은 사진에서와 같이 저에코로 관찰되며 간과 비교하여 비슷하거나 좀 더 저에코로 보인다[ 3]. 이러한 피질은 간질의 섬유화, 관상의 위축, 염증 그리고 사구체경화증이 동반될 경우 에코가 증가하여 고에코로 보이며[ 4], 부종이 동반되었을 때는 조금 더 저에코로 관찰된다. 신장의 중심부는 부비동(sinus) 지방으로 인하여 고에코로 보인다.
낭성종괴
단순신낭종(simple renal cyst)
신장에서 관찰되는 종괴 중 가장 흔한 종괴는 신낭종이다. 신낭종은 대부분 둥근 모양의 단순 피질 낭종 형태를 띤다. 내부 에코는 무에코이며 후방음영 증가를 보이고 부드러운 피막에 둘러싸여 있다[ 5]. 50세 이상인 사람들의 최소 50%가 신장 중 하나에서 단순낭종을 가지고 있기 때문에 발생 빈도는 연령에 따라 증가한다. 단순낭종은 양성 종괴이므로 추가적인 검사가 필요하지 않다( Fig. 2) [ 6].
복합신낭종(complex renal cyst)
복합낭종은 액체로 이루어진 내부를 나누는 막을 가지고 있으며, 이 막은 석회화와 두꺼워진 벽을 포함하기도 한다. 복합낭종은 도플러 초음파로 평가할 수 있으며, Bosniak계 분류 및 복합낭종의 추적검사로 조영증강 초음파 또는 CT가 사용된다. Bosniak 분류는 단순한 낭종에 해당하는 Bosniak I부터 고체 부분이 있는 낭종에 해당하는 Bosniak IV까지 네 그룹으로 나뉜다( Table 1). 신낭종의 악성 여부를 판단하는 기준은 CT 소견을 이용한 Bosniak 분류를 이용한다[ 7, 8]. Bosniak I은 단순 양성 낭종으로 무에코이며, 타원형 모양으로 얇고 부드러운 벽으로 둘러싸여 있고, 석회화나 벽의 두꺼워짐은 없다. 악성화 가능성은 1% 미만으로 추적 관찰이 필요하지 않다. Bosniak II는 일부 비정상적인 낭성 병변을 가지고 있다. 1 mm 미만의 중격이 있거나 또는 미세한 석회화가 있고 직경이 3 cm 미만이다. 악성화 가능성은 3% 이하로 추적 관찰이 필요하지 않다( Fig. 3). Bosniak IIF는 이상 소견이 증가된 낭성 병변으로 여러 개의 얇은 중격이 있으며 격벽이 비후되어 있고 석회화가 두껍게 나타날 수 있다. 크기는 3 cm 이상이며 5-10%에서 악성화 위험성이 있어 추적 관찰이 필요하다( Fig. 4). Bosniak III는 불균일한 두꺼운 벽으로 되어 있고 결절성을 보이며 두껍고 불규칙한 석회화가 나타나며 격벽이 많이 두꺼워져 있다. 악성화 가능성은 40-60%로 수술적 제거술이 권장된다( Fig. 5). Bosniak IV는 낭종의 크기가 크며 불규칙한 경계와 큰 결절이 관찰된다. 고형종괴와 독립된 격벽이 나타나며 악성화 가능성은 80% 이상으로 수술이 권고된다( Fig. 6) [ 9].
다낭성 신질환(polycystic kidney disease)
다낭성 신질환은 크기가 다른 여러 개의 낭종이 서로 밀접하게 접촉하여, 낭종이 거의 모든 신장 부위를 채우게 되는 상태를 의미한다. 이 병의 진행단계는 신장에서 대뇌 피질낭 분화의 결핍으로 확대된다[ 10]. 초음파에서는 다발성의 신낭종이 관찰되며 유전성 질환이나 장기 투석 환자의 신장에서 관찰된다. 이 중 상염색체 우성 다낭신질환이 가장 흔하며 심각한 유전병중의 하나이다. 유병률은 1:500-1:1,000이며 말기 신질환의 가장 흔한 유전적 원인이다. 태어났을 때는 정상 신장이나 시간이 지남에 따라 다발성 낭종이 발생한다. 30세가 되면 68%의 환자에서 초음파에서 눈에 보일만 한 낭종이 관찰된다[ 11]. 대부분 초음파에서 단순낭종의 모양을 가지나, 출혈이나 감염이 있는 낭종은 낭종내 에코를 가지는 물질이 관찰되며, 석회화가 발생할 수 있다( Fig. 7).
고형종괴(solid renal mass)
고형종괴는 초음파검사 상에서 낭종과 달리 잘 구분되는 매끄러운 벽이 없으며 내부에코는 신실질과 비교하여 등에코, 저에코 그리고 고에코의 다양한 소견을 보일 수 있다. 일부에서는 도플러 신호가 보일 수 있으며, 이러한 종괴는 악성일 가능성이 높다[ 12].
신세포암(renal cell carcinoma)
가장 흔한 신실질종양은 신세포암으로 신장의 악성 종양 중 90%를 차지한다[ 13]. 신세포암의 초음파 소견은 일반적으로 유원형으로 등에코를 보이며 신실질의 주변부에 위치한다. 팽창성 발육으로 보이며 신장 외측으로 돌출되는 경우도 많다. 하지만 저에코나 고에코로도 보이기도 하며 수질이나 부비동의 중앙에서 발견되기도 한다( Fig. 8). 도플러 소견에서는 혈류 신호가 많은 과혈관성으로 관찰된다. 3 cm 이하의 작은 신세포암에서는 약 77%에서 고에코로 관찰되나, 3 cm 이상에서는 정상 신장피질과 비교하여 등에코 또는 저에코로 관찰되기도 한다[ 14]. 3 cm 이하에서 고에코로 보이는 신세포암은 혈관근지방종과 유사하기 때문에 감별이 필요하다.
혈관근지방종(angiomyolipoma)
혈관근지방종은 비정상적인 혈관, 방추세포 그리고 성숙한 지방세포로 이루어져 있으며, 임상에서 관찰되는 가장 흔한 양성종괴이다[ 15]. 혈관근지방종의 유병률은 여성 대 남성 비율이 2:1이며 결절성 경화증 환자에서 좀 더 많이 발견된다. 혈관근지방종의 80%는 초음파에서 우연히 발견되며, 10%에서만 증상을 유발한다[ 16]. 초음파 모양은 대개 크기는 작고(< 4 cm), 지방으로 인하여 경계가 명료한 유원형의 균질한 고에코로 관찰된다( Fig. 9). 혈관근지방종은 초음파 상에서 이러한 특징적인 소견을 보이지만 고에코로 보이는 신세포암과 감별이 필요하기 때문에 CT가 권고된다[ 17].
가성종양(pseudotumor): 두꺼운 신장기둥(prominent column of bertin)
두꺼운 신장기둥은 신장의 피라미드 사이에 정상적으로 존재하는 피질조직이 종괴처럼 확대된 형태로 나타난다[ 18]. 초음파 상에서 신피질과 같은 에코, 부드러운 신장 윤곽 및 후방음향강화가 나타나지 않는 특징이 있어 쉽게 구분할 수 있다( Fig. 10) [ 19]. 게다가 도플러 초음파에서는 버틴의 중격은 신장실질과 비슷한 동맥과 정맥 흐름 패턴이 나타난다[ 20].
가성종양(pseudotumor): 낙타혹(dromedary hump)
낙타혹은 신장의 자국으로 인하여 좌측 신장의 외측 경계에서 국소적으로 팽창한 형태로 나타난다. 낙타혹은 초음파에서 신실질과 같은 에코를 가지고, 도플러에서 정상 혈류를 보여주기 때문에 쉽게 구분이 된다( Fig. 11) [ 21].
결 론
신초음파는 간단하고 상대적으로 가격이 저렴하며, 신종괴를 신속히 감별하는 데 도움이 되는 검사법이다. 단순낭성종괴에서는 추가적인 검사가 필요하지 않으나 복합낭성종괴에서는 악성화 여부를 판단해야 하며, 고형종괴에서는 신세포암과의 감별이 필요하다. 실질적으로 종괴는 아니나, 종괴처럼 보이는 가성종괴도 있다. 종괴의 특징적인 소견을 이해하면, 초음파를 이용하여 효과적으로 신종괴를 진단하고 추적 관찰할 수 있다.
Figure 1.
Ultrasonography finding of normal kidney. 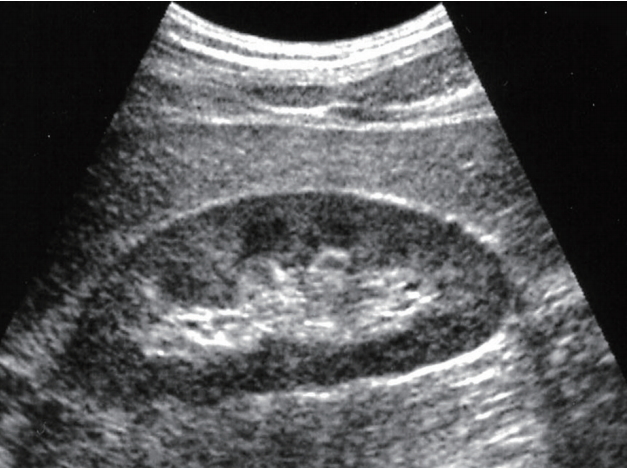
Figure 2.
Simple renal cyst. Ultrasonography demonstrates a cyst with well marginated, anechoic density, and no septation. Posterior enhancement is shown (arrow). 
Figure 3.
Bosniak class II. Ultrasonography demonstrates a cyst with thin septations (arrow), small and fine calcifications. 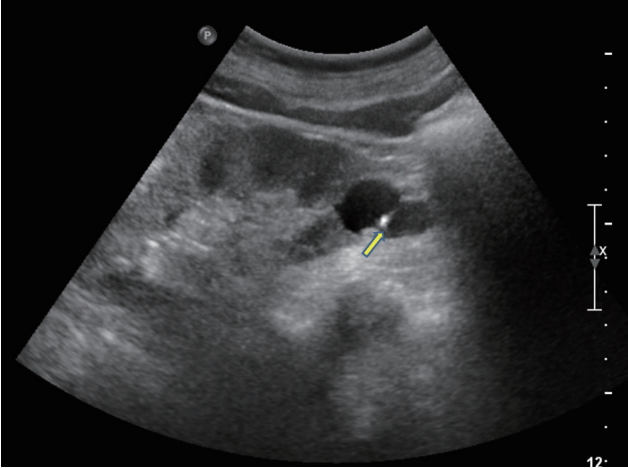
Figure 4.
Bosniak class IIF. Ultrasonography demonstrates a cyst with nodular calcifications (arrow). 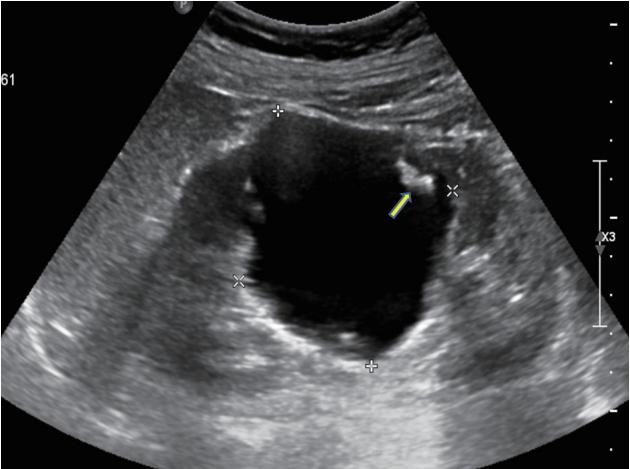
Figure 5.
Bosniak class III. Ultrasonography demonstrates a cyst with thick-walled cystic lesion, septum irregularity and heterogeneous septum and wall and/or contents. 
Figure 6.
Bosniak class IV. Ultrasonography demonstrates a cyst with solid component and independent of finding of wall. 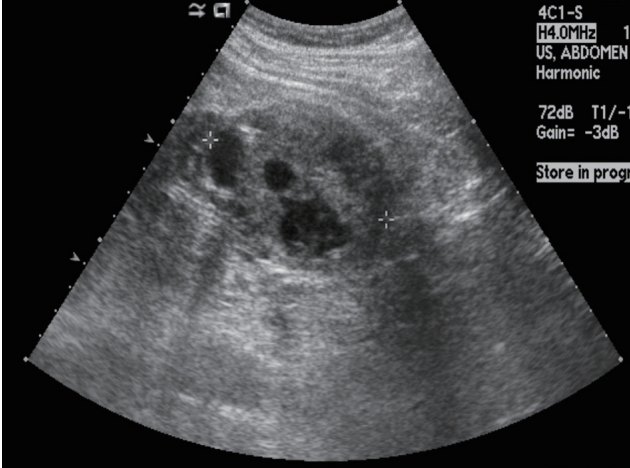
Figure 7.
Advanced polycystic kidney disease with multiple cysts. 
Figure 8.
Renal cell cancer. (A) 6.4 cm sized hyperechoic mass is seen in renal parenchyme, (B) out protruding isoechoic right renal mass is observed. 
Figure 9.
Angiomyolipoma. A hyperechoic mass is seen in the upper pole of an adult kidney (arrow). 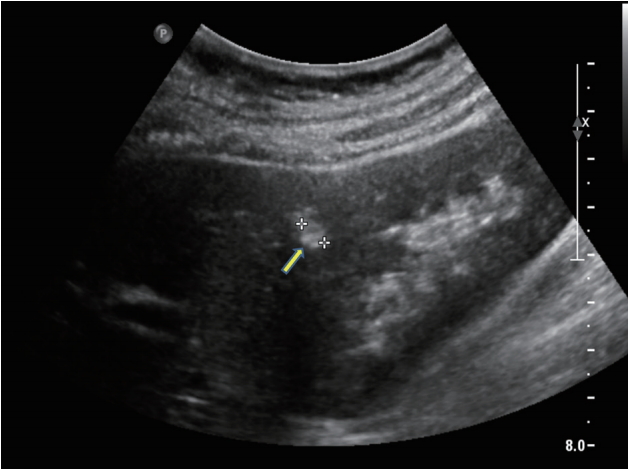
Figure 10.
Prominent column of bertin. Ultrasonography shows a “mass-mimicking” unfolding of cortical renal tissue (arrow) between renal medullary pyramids. 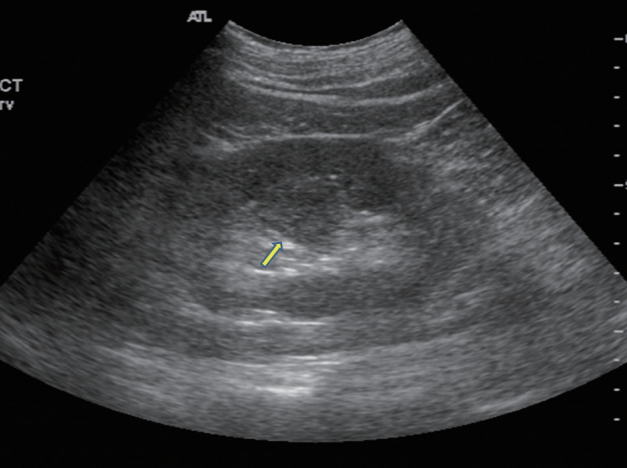
Figure 11.
Dromedary hump. Prominent focal bulges (arrow) on the lateral border of the left kidney is demostrated. 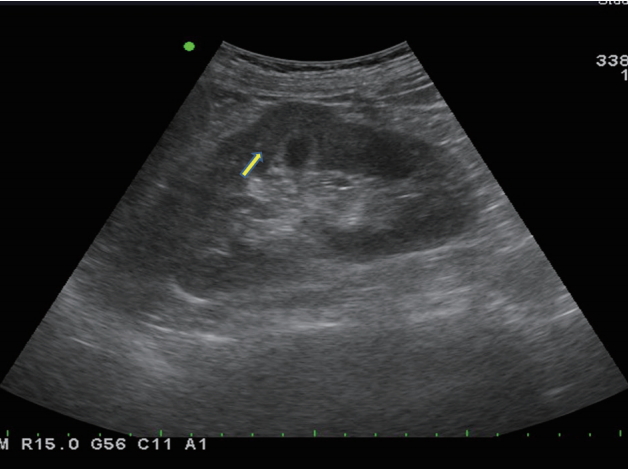
Table 1.
Bosniak's radiological classification of renal cyst
|
Category |
Characteristics |
|
I |
Water density, thin margins, sharp delineation with the renal parenchyma, thin and smooth walls, homogeneous |
|
II |
Presence of one or few thin septations, small and fine calcifications; hyperdense cysts measuring up to 3.0 cm |
|
IIF |
More complex lesions which cannot be included in category II or III. Multiple septa. Walls or septa with nodular or irregular calcifications. Hyperdense cysts > 3.0 cm or with only 25% of their walls visible (exophytic) |
|
III |
Thick-walled cystic lesion, septum irregularity and heterogeneous septum and wall and/or contents. Gross and irregular calcifications with measurable enhancement |
|
IV |
Lesions with all the findings of category III, and solid component, soft parts, independent of finding of wall or septa |
REFERENCES
1. Khademi M. Angiographic measurement of renal compartments: corticomedullary ratio in normal, diseased states and sickle cell anemia. Radiology 1974;113:51–58.   2. Raj DS, Hoisala R, Somiah S, et al. Quantitation of change in the medullary compartment in renal allograft by ultrasound. J Clin Ultrasound 1997;25:265–269.   3. Manley JA, O'Neill WC. How echogenic is echogenic? Quantitative acoustics of the renal cortex. Am J Kidney Dis 2001;37:706–711.   4. Page JE, Morgan SH, Eastwood JB, et al. Ultrasound findings in renal parenchymal disease: comparison with histological appearances. Clin Radiol 1994;49:867–870.   5. Pedersen JF, Emamian SA, Nielsen MB. Simple renal cyst: relations to age and arterial blood pressure. Br J Radiol 1993;66:581–584.   6. Bosniak MA. Diagnosis and management of patients with complicated cystic lesions of the kidney. AJR Am J Roentgenol 1997;169:819–821.   7. Bosniak MA. The current radiological approach to renal cysts. Radiology 1986;158:1–10.   8. McGuire BB, Fitzpatrick JM. The diagnosis and management of complex renal cysts. Curr Opin Urol 2010;20:349–354.   10. O’Neill WC, Robbin ML, Bae KT, et al. Sonographic assessment of the severity and progression of autosomal dominant polycystic kidney disease: the Consortium of Renal Imaging Studies in Polycystic Kidney Disease (CRISP). Am J Kidney Dis 2005;46:1058–1064.   11. Patel NA, Suthar PP. Ultrasound appearance of congenital renal disease: pictorial review. The Egyptian Journal of Radiology and Nuclear Medicine 2014;45:1255–1264.  12. Hélénon O, Correas J, Balleyguier C, Ghouadni M, Cornud F. Ultrasound of renal tumors. Eur Radiol 2001;11:1890–1901.   14. Forman HP, Middleton WD, Melson GL, McClennan BL. Hyperechoic renal cell carcinomas: increase in detection at US. Radiology 1993;188:431–434.   15. Flum AS, Hamoui N, Said MA, et al. Update on the diagnosis and management of renal angiomyolipoma. J Urol 2016;195(4 Pt 1):834–846.   16. Sooriakumaran P, Gibbs P, Coughlin G, et al. Angiomyolipomata: challenges, solutions, and future prospects based on over 100 cases treated. BJU Int 2010;105:101–106.   18. Silverman SG, Israel GM, Herts BR, Richie JP. Management of the incidental renal mass. Radiology 2008;249:16–31.   19. Lafortune M, Constantin A, Breton G, Vallee C. Sonography of the hypertrophied column of bertin. AJR Am J Roentgenol 1986;146:53–56.   21. Mazziotti S, Zimbaro F, Pandolfo A, Racchiusa S, Settineri N, Ascenti G. Usefulness of contrast-enhanced ultrasonography in the diagnosis of renal pseudotumors. Abdom Imaging 2010;35:241–245.  
|
|






















