유방암 환자에서 발견된 국소결절성과증식의 진행
요약
본 증례에서는 초기 영상 검사에서 전형적인 국소결절성과증식의 소견을 보여 추적 관찰을 하였으나 크기 증가 및 기저 악성 질환력이 있어 간조직검사를 시행하여 국소결절성과증식을 확진하였다. 국소결절성과증식은 발생 초기에는 크기나 모양 변화 소견이 관찰될 수 있으며 악성 종괴로의 변화 가능성이 거의 없지만, 본 증례에서는 지방간으로 인하여 초음파 검사로 종괴의 특징을 명확히 확인하기가 어렵고, 크기 변화로 인해 악성 질환의 전이 가능성을 배제할 수 없어 정확한 감별진단이 필요하여 간조직 검사를 시행하였으며, 이를 통해 안전하게 추적관찰 계획을 확립할 수 있었다.
중심 단어: 국소결절성과증식; 지방간; 타목시펜; 간; 변화
Abstract
Most liver masses that are incidentally found are benign lesions. Focal nodular hyperplasia (FNH) is the second most common benign solid hepatic mass that does not transform to malignancy. A 43-year-old woman who was diagnosed with breast cancer recently visited our clinic for evaluation of an incidentally found hepatic mass. Abdominal computed tomography and magnetic resonance imaging showed two lesions on segment 6 of the liver, suggestive of FNH. The patient had undergone surgery for breast cancer and had been taking tamoxifen. We followed the lesions on abdominal ultrasound every six months. Imaging at two years after diagnosis revealed fatty change of the liver parenchyma and increased size and number of masses. Liver biopsy was performed to distinguish metastatic lesions. Conclusively, FNH with drug-induced steato-hepatitis was confirmed by histopathologic finding. We are following the patient with imaging study and liver fibroscan.
Keywords: Focal nodular hyperplasia; Fatty liver; Tamoxifen; Liver
서 론
영상 검사 기술의 발달과 주기적인 검진의 증가로 무증상 환자에서 간 종괴가 우연히 발견되는 경우가 증가하고 있다[ 1]. 만성 바이러스성 간염이나 간경변 등의 기저 간질환이나 위험인자가 없는 경우 대부분 양성 병변이지만, 때로는 악성과의 감별을 위해 복부초음파 검사 후 복부전산화단층촬영(computed tomography, CT)이나 자기공명영상 (magnetic resonance imaging, MRI) 등의 추가적인 영상 검사가 필요한 경우가 있다. 흔히 발견되는 양성 간 종괴로는 혈관종, 국소결절성과증식, 간선종, 간낭종 등이 있으며 감별이 필요한 악성 종괴로는 간세포암종, 전이성 간암, 간내담도암 등이 있다[ 2]. 특히, 복부초음파 검사에서 지방간이 있을 때 저에코성으로 보이는 간 종괴는 양성과 악성의 감별을 위해서 영상 검사 외에 조직 검사까지 필요한 경우도 있다. 저자는 유방암이 진단된 환자에서 우연히 발견된 저에코성 간 종괴가 영상학적으로 국소결절성과증식으로 진단되었으나, 추적검사 중 항암제에 의한 지방간 변화를 배경으로 비교적 빠르게 크기와 개수가 증가하는 소견을 보였고, 악성 여부 및 전이성 병변 감별을 위해 시행한 조직검사에서 최종적으로 국소결절성과증식으로 진단된 증례에 대해 보고하고자 한다.
증 례
43세 여자환자가 좌측 유방의 유관상피내암(ductal carcinoma in situ, DCIS) 진단 후 병기 설정을 위한 영상검사 시행 중 발견된 간 종괴에 대해 소화기내과에 진료 의뢰되었다. 내원 당시 생체징후는 안정적이었으며, 시행한 혈액검사 결과는 white blood cell 6.3 × 103/μL, hemoglobin 11.5 g/dL, platelet 287 × 103/μ L, aspartate transaminase 14 U/L, alanine transaminase 11 U/L, gamma-glutamyl transferase 14 U/L, alkaline phosphatase 56 U/L, total bilirubin 0.5 mg/dL, blood urea nitrogen 14.9 mg/dL, creatinine 0.80 mg/dL, HBs Ag/Ab (-/-), HBc-Ab IgG (-), HCV Ab (-)였다. 종양 표지자는 Alpha-fetoprotein (AFP) 2.31 ng/mL, Prothrombin induced by vitamin K absence-II (PIVKA-II) 25 mAU/mL, Carbohydrate antigen 19-9 (CA 19-9) 3.5 U/mL으로 정상 수치가 확인되었고, 키 158.6 cm, 몸무게 56.6 kg으로 체질량지수(body mass index, BMI)는 22.5 kg/m2였다. 환자는 고혈압 외에 다른 병력은 없었으며 과거 스테로이드 제제나 호르몬 관련 약물 복용력도 없었다. 직계 가족 내에서 간암 및 간질환의 가족력은 없었다.
복부 CT에서 6번 구획(S6)에 1.2 cm 크기의 동맥기에 조영 증강되는 결절이 관찰되었으며, 추가로 시행한 MRI에서 경도의 지방간 소견과 함께 CT와 같은 위치에 T2 강조영상에서 고강도, T1 강조영상에서 동등도를 보이는 병변이 관찰되었다. 병변은 동맥기에서 조영 증강을 보이고 간담도기에서 주변부 조영 증강이 지속되었다. 또한, 동일한 양상의 더 작은 결절이 S6에 관찰되었다( Fig. 1). 환자는 DCIS에 대해서 편측 유방절제술 시행하였고 면역조직화학 염색 결과 에스트로겐 수용체 양성으로 선택적 에스트로겐 수용체 조절제인 Tamoxifen 복용을 시작하였다. 6개월 뒤 추적한 복부 CT에서 이전에 비해 지방간이 진행된 소견이 있었으나 결절의 동맥기 조영 증강 양상 및 크기 변화는 보이지 않아, 이후 2년간 6개월마다 복부초음파를 이용하여 간 내 결절과 지방간에 대해 추적하였다( Fig. 2). 복부초음파에서는 지방간에 의한 고에코 간 실질을 배경으로 고에코 테두리(hyperechoic rim)을 동반하고 내부는 저에코인 결절이 지속적으로 관찰되었고, 도플러 이미지에서 결절 내부에 혈관이 관찰되었다( Fig. 3). Tamoxifen 복용 후 지방간 악화로 시행한 간섬유화 스캔 검사 상, 감쇄매개변수(controlled attenuation parameter) 330 dB/m, 간탄성도(liver stiffness value) 4.0 kPa로 간 내 지방증이 심한 상태였으며, 체중은 56.9 kg, BMI 22.45 kg/m 2로 변화 없었다. 추적 2년째에 시행한 복부 CT에서 결절의 크기는 1.7 cm으로 증가하였고, 이전 CT에서 관찰되었던 S6의 병변들 외에도 간 좌엽에 같은 양상의 새로운 다발성 결절이 발견되었다. 3개월 뒤 복부 MRI를 추적하였으며, 가장 큰 종괴의 크기는 1.9 cm으로 2년 간 약 0.7 cm의 크기 증가가 확인되었고, CT와 마찬가지로 양측 간엽에 다발성 결절성 병변이 확인되었다( Fig. 4). 환자의 유방암 병력과 종괴 크기의 빠른 증가, 다발성 병변인 점을 고려하였을 때 간선종 및 전이성 암 등을 포함한 악성 간 종괴에 대한 배제가 필요하다고 판단하여 간 조직검사를 시행하였다. 간 바늘 조직검사는 S6의 주 병변에 대해 시행하였으며 현미경 소견 상 국소적으로 섬유성 중격에 의해 경계가 지어지는 간경화 결절 유사한 병변이 확인되고, 확장된 간문맥에서는 혈관벽이 두꺼운 혈관이 관찰되었다. 이 병변은 Glutamine synthetase 면역조직화학 염색 상, 얼룩진 양상의 양성 소견을 보여, 국소결절성과증식(focal nodular hyperplasia, FNH)에 합당하였다. 주변부의 간소엽은 대공지방세포증(macrovesicu la r fatt y change)과 함께 소엽 내 염증이 침윤한 소견이 관찰되었고, 이는 비알코올성 지방간염(nonalcoholic steatohepatitis)의 NAS(nonalcoholic fatty liver disease [NAFLD] activity score) 4점에 합당하였다( Fig. 5). 따라서 FNH 병변과 지방간에 대해서는 특별한 치료 없이 복부초음파 검사와 간섬유화 스캔 검사를 시행하며 추적 관찰 중이다.
고 찰
국소결절성과증식(FNH)은 혈관 기형이나 손상에 대한 간세포의 과증식성 반응에 의해 발생한다고 알려진 대표적인 양성 간종양으로, 20–50대의 여성에서 호발하며 대부분 무증상이므로 치료가 필요하지 않다[ 3, 4]. 일반적으로 20%의 환자에서는 복부초음파 상 중심성 반흔(central scar)을 동반한 등에코성 병변으로 관찰되지만, 3 cm 미만의 병변의 경우 중심성 반흔을 동반하지 않는 경우가 많아 간선종, 혈관종이나 다른 악성 종양과의 감별이 어려울 수 있다[ 5]. 전형적인 조영증강 초음파(Contrast-enhanced ultrasonography)의 소견은 조영제 주입 후 동맥기에 주변부 간 실질보다 빠르게 조영 증강되며, 중심부 동맥으로 인한 spoke wheel pattern이 관찰되고, 문맥기와 지연기에서 씻김 현상(wash out) 없이 조영 증강이 지속된다[ 6]. CT에서는 조영 전 검사에서 저음영 또는 등음영으로 관찰되며, 동맥기에 균일하게 조영되어 고음영으로 관찰되다가 문맥기에 등음영, 지연기에는 등음영의 병변 내에 고음영의 중심성 반흔이 관찰된다[ 7]. MRI는 75%의 민감도와 98%의 특이도를 가지는 검사로, 특징적으로 중심성 반흔이 T2 강조영상에서 고강도로 관찰된다. FNH는 영상 검사로 대부분 진단이 가능하여 조직검사가 필수적이지 않으나, 영상 소견이 전형적이지 않을 경우 감별을 위해 조직검사를 시행할 수 있다. 본 증례 환자의 경우 지방간으로 인한 주변 간 실질의 고에코 성으로 인해 병변은 상대적으로 저에코성으로 관찰되었다. 기저 지방간이 있는 경우 여러 간 내 병변들이 상대적 저에코성 병변으로 대조가 되며 구분이 잘 될 수는 있지만 일반적인 초음파 양상에 비해 특징적 소견을 이용한 병변 감별에는 제한이 있다. 간혈관종은 기저 간실질의 에코가 정상일 경우 고에코성 병변으로 관찰되나 지방간이 있을 경우 상대적으로 저에코성으로 나타날 수 있다. 지방간에서 남아있는 일부 정상 간조직이 상대적으로 저에코성 종괴처럼 오인될 수 있으며, 2 cm 미만의 작은 간세포암종도 저에코성 병변으로 관찰될 수 있다[ 8]. 그 외에도 본 증례와 같이 FNH 역시 일반 간 실질에서는 등에코성이나 약하게 저에코성으로 관찰되나 지방간이 있을 경우 대조가 뚜렷해진다. 전이성 간암에서 초음파상 저에코를 보이는 경우 일반적으로 저 혈관성 타입으로 유방암, 폐암, 위암, 췌장암, 식도암 등에서 관찰되며, 본 환자의 경우 유방 내 악성 종괴 수술을 시행한 기저 질환력과 더불어 간 내 병변의 크기가 조금씩 증가하여 악성 병변과의 감별이 필요했기에 간조직검사를 시행하였다. 대부분의 FNH는 단일 병변이나 20–30%에서 다발성 병변으로 나타난다. 과거의 연구들에서는 대부분 크기 변화가 없거나 줄어드는 변화를 보였으나, 조직학적으로 FNH로 진단된 병변에 대해 추적 시 크기가 증가하는 경우도 드물게 있었다. 조직학적 소견으로 전형적인 형태(70–80%)와 비전형적인 형태(20–30%)로 분류할 수 있으며, 전형적인 소견으로는 중심성 반흔, 간 세포의 결절성 구조, 담세관의 증식 등이 있다[ 9]. FNH의 발생 기전이 혈관성 자극에 대한 증식성 반응이라는 점을 고려하였을 때, 발생 초기에 진단이 된 경우 빠른 크기 증가 소견이 관찰될 가능성이 높을 것이라고 추측한다. 이러한 점에서 본 환자의 경우도 장기 추적 시 병변의 최대 크기에 도달 후 안정 상태로 지속될 것을 예측해 볼 수 있다. 일반적으로 영상학적 검사에서 특징적인 소견을 보이며 무증상인 FNH는 특별한 치료방침 없이 경과관찰이 가능하지만, 비전형적인 영상 소견을 보이거나 추적 검사에서 악성화를 완전히 배제하기 어려운 경우, 병변의 크기나 위치에 따라 증상을 일으키는 경우에는 수술적 절제를 고려한다. 또한, 최소한의 침습적인 치료를 위해 최근 경동맥 색전술(transarterial embolization)에 대한 연구도 제시되고 있다[ 10- 12]. 환자는 무증상이며 조직검사에서 FNH로 진단된 상태이므로 향후 정기적으로 지방간 검사 추적 시에 FNH의 변화도 같이 확인할 계획이다. Tamoxifen은 약제유발지방간염(drug-induced Steatohepatitis)을 유발할 수 있는 대표적인 약제 중 하나로, Tamoxifen 복용 환자의 약 1/3에서 영상학적으로 지방간 소견이 나타난다[ 13, 14]. 그러나 임상적으로 유의미한 지방간염 소견이 나타나는 경우는 드물기 때문에 Tamoxifen을 복용하는 모든 환자에게서 간기능 검사나 간에 대한 영상검사를 추적해야 할 필요는 없으며, 유방암의 재발 위험도와 간 손상 정도 등을 고려하여 약제 중단 여부를 결정한다. 높은 BMI (≥25 kg/m 2)와 고중성지방혈증, 낮은 고밀도 콜레스테롤 등이 Tamoxifen 유발 지방간의 위험인자이며[ 15], 본 증례 환자의 경우 진단 당시부터 추적 3년째까지 BMI가 정상 수치로 유지되고 있음에도 불구하고 Tamoxifen 복용 시작 후 추적한 간섬유화 스캔에서 지속적으로 지방간 소견이 확인되고 있어, 이는 약제에 의한 영향이 큰 것으로 생각된다. 다만 환자의 경우 약제 유지가 불가피하여 체중 감량 및 근력운동 위주의 생활 습관 교정을 병행하며 지방간의 호전을 기대하고 있다. 또한, Tamoxifen과 FNH 진행의 상관성을 고려하였을 때, 이전 연구들에서 간 내 손상을 유발할 수 있는 항암치료 후 FNH 발생에 대한 보고들이 있으나 Tamoxifen과 FNH의 직접적인 상관성에 대해서는 제시된 바가 없다[ 16, 17]. 또한, Tamoxifen이 선택적 에스트로겐 수용체 조절제인 점을 고려하였을 때 과거 에스트로겐이나 프로게스테론과 같은 여성호르몬이 FNH의 진행과 관련이 있다고 알려졌으나, 최근 보고들에서는 관련이 없다는 보고들이 많아서 향후 추가 결과가 필요하다[ 18- 22].
Figure 1.
Initial MRI findings of FNH, showing a 1.2-cm-sized T2-high (A) T1-iso signal intensity lesion with arterial enhancement and persistent enhancement on hepatobiliary phase (B) and another smaller lesion showing the same enhancement patten in S6 (C, D). FNH, focal nodular hyperplasia; MRI, magnetic resonance imaging. 
Figure 2.
Liver dynamic contrast-enhanced computed tomography at the six-month follow-up. The liver showed increased parenchymal attenuation. A 1.2-cm-sized nodular lesion in S6 was observed without interval change but showed enhancement on arterial phase and high signal intensity on delayed phase. 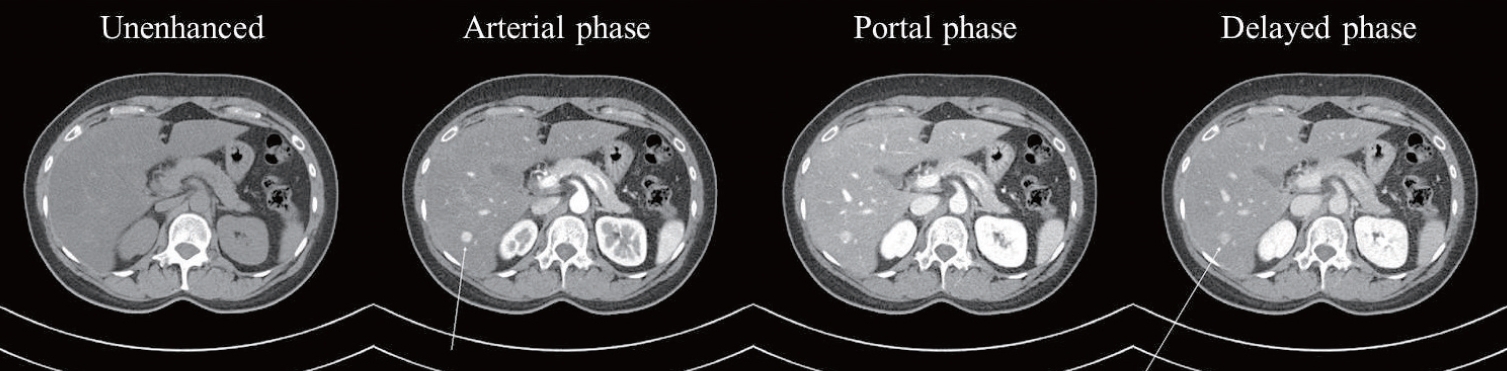
Figure 3.
Ultrasonography at the two-year follow-up showing a 2.1-cm-sized hypoechoic lesion at S6 with a Doppler vascular pattern. 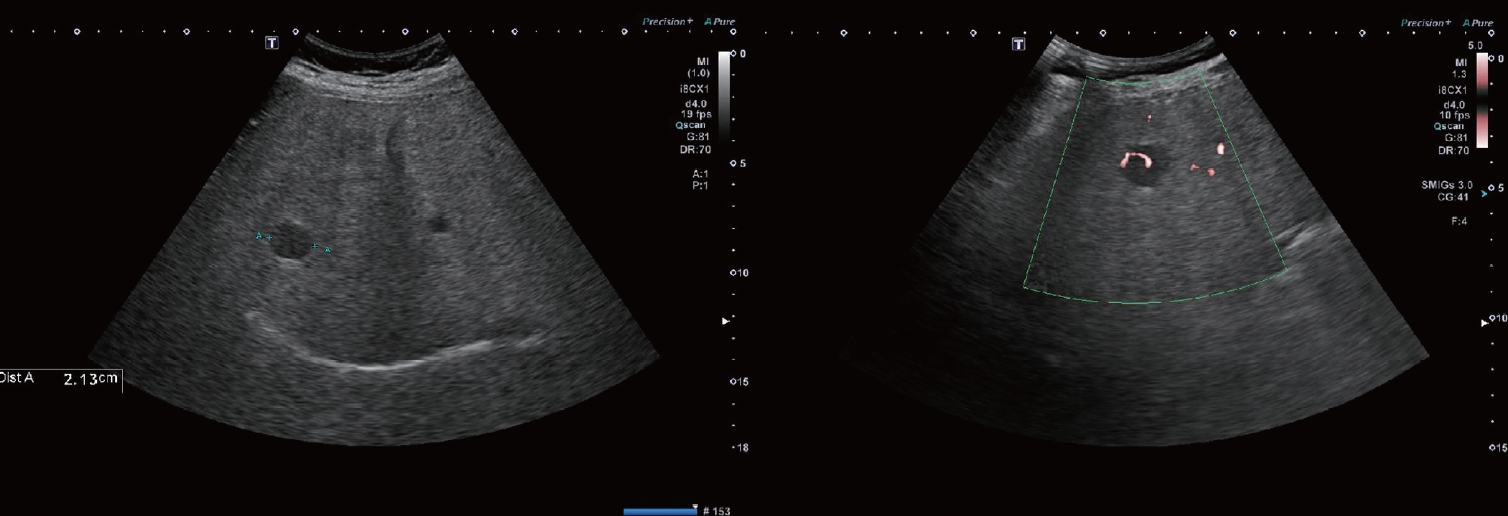
Figure 4.
MRI findings at the two-year follow-up. (A) T2-weighted MRI sequence showing increased size of the lesion. (B) Newly appeared multiple T2 high, T1 iso SI lesions in S6, with arterial enhancement and persistent peripheral enhancement on hepatobiliary phase. FNH, focal nodular hyperplasia; MRI, magnetic resonance imaging. 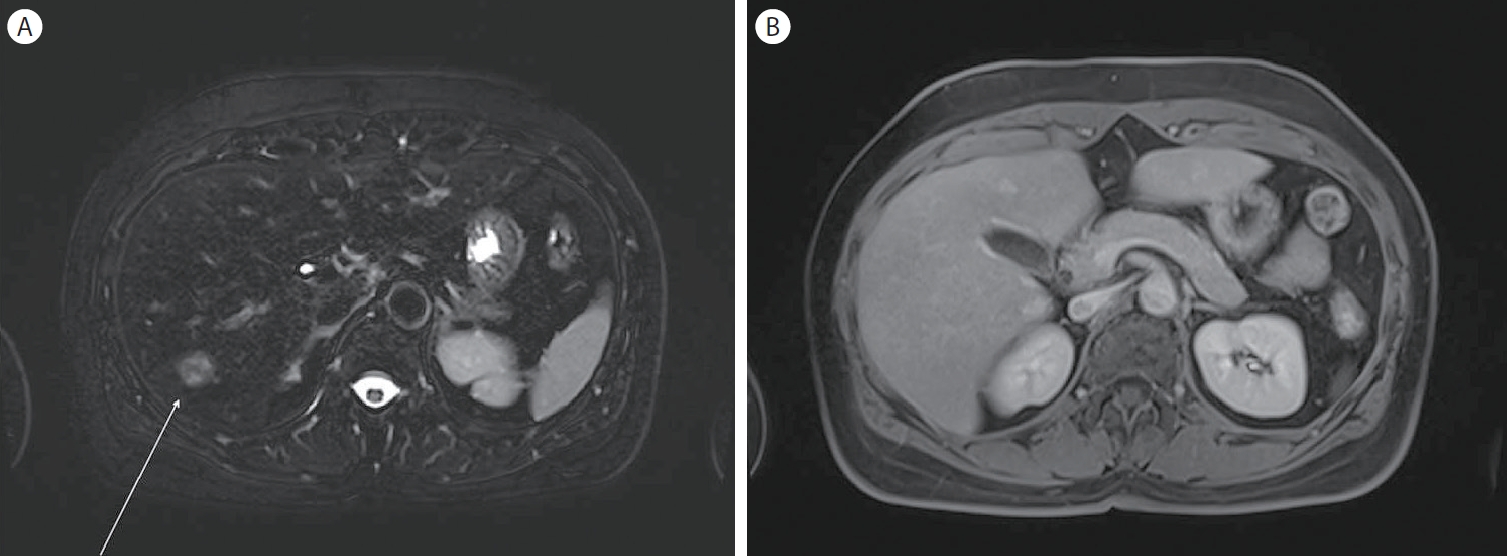
Figure 5.
Histopathologic findings of liver biopsy. (A) Needle biopsied liver showing a hepatocellular lesion (central portion) and the surrounding liver with macrovesicular fatty change (left side) (H&E, ×40). (B) Hepatocellular lesion showing mildly disrupted lobular architecture and expanded portal tract with septal fibrosis and occasional thick-walled vessels in the septa (H&E, ×100). (C) Glutamine synthetase showing patchy staining in the hepatocellular lesion (GS-6, ×100). (D) The surrounding lesion showing macrovesicular steatosis (arrow) and focal area of lobular inflammatory infiltration (arrow head) (H&E, ×200). 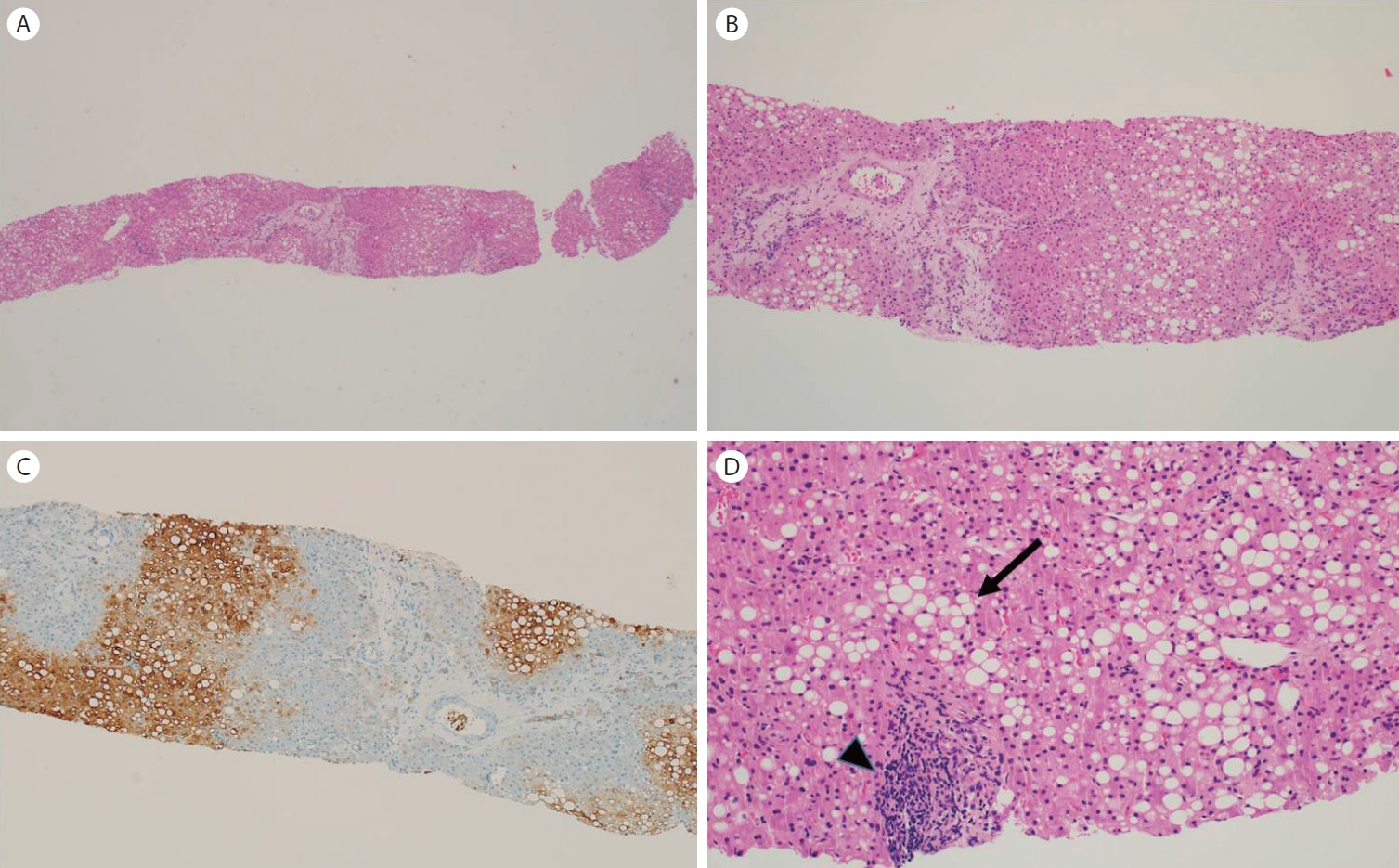
REFERENCES
2. Jeong SW. Diagnosis of focal liver masses on ultrasonography. Clin Ultrasound 2017;2:9–20.   4. Myers L, Ahn J. Focal nodular hyperplasia and hepatic adenoma: Evaluation and management. Clin Liver Dis 2020;24:389–403.  6. Piscaglia F, Venturi A, Mancini M, et al. Diagnostic features of real-time contrast-enhanced ultrasound in focal nodular hyperplasia of the liver. Ultraschall Med 2010;31:276–282.   7. Carlson SK, Johnson CD, Bender CE, Welch TJ. CT of focal nodular hyperplasia of the liver. AJR Am J Roentgenol 2000;174:705–712.   8. Shin YM. Case discussion: Radiologic differential diagnosis of solid hepatic lesions. Clin Mol Hepatol 2012;18(Suppl 1):39–49.
9. Nguyen BN, Fléjou JF, Terris B, Belghiti J, Degott C. Focal nodular hyperplasia of the liver: a comprehensive pathologic study of 305 lesions and recognition of new histologic forms. Am J Surg Pathol 1999;23:1441–1454.  10. Kuo YH, Wang JH, Lu SN, et al. Natural course of hepatic focal nodular hyperplasia: a long-term follow-up study with sonography. J Clin Ultrasound 2009;37:132–137.   11. Virgilio E, Cavallini M. Managing focal nodular hyperplasia of the liver: Surgery or minimally-invasive approaches? A review of the preferable treatment options. Anticancer Res 2018;38:33–36.  13. Nishino M, Hayakawa K, Nakamura Y, Morimoto T, Mukaihara S. Effects of tamoxifen on hepatic fat content and the development of hepatic steatosis in patients with breast cancer: high frequency of involvement and rapid reversal after completion of tamoxifen therapy. AJR Am J Roentgenol 2003;180:129–134.   14. Ogawa Y, Murata Y, Nishioka A, Inomata T, Yoshida S. Tamoxifen-induced fatty liver in patients with breast cancer. Lancet 1998;351:725.   16. Kumagai H, Masuda T, Oikawa H, Endo K, Endo M, Takano T. Focal nodular hyperplasia of the liver: direct evidence of circulatory disturbances. J Gastroenterol Hepatol 2000;15:1344–1347.   17. Bouyn CI, Leclere J, Raimondo G, et al. Hepatic focal nodular hyperplasia in children previously treated for a solid tumor. Incidence, risk factors, and outcome. Cancer 2003;97:3107–3113.   19. Mathieu D, Kobeiter H, Maison P, et al. Oral contraceptive use and focal nodular hyperplasia of the liver. Gastroenterology 2000;118:560–564.   20. Song KH, Lee KU, Kim JH, et al. Clinical analysis of focal nodular hyperplasia of the liver in 11 patients. Korean J Hepatobiliary Pancreat Surg 2007;11:41–46.
21. Kang HY, La SS, Kong JH, et al. [Clinical, radiological and pathological exploration of focal nodular hyperplasia of liver reported in Korea]. Korean J Gastroenterol 2008;52:376–383. Korean.  22. Mathieu D, Kobeiter H, Cherqui D, Rahmouni A, Dhumeaux D. Oral contraceptive intake in women with focal nodular hyperplasia of the liver. Lancet 1998;352:1679–1680.  
|
|
















