초음파 검사에서 거대 과혈관성 종괴로 발견된 신장 호산성과립세포종
Renal Oncocytoma Presenting as a Huge Hypervascular Mass on Ultrasound
Article information
Abstract
상복부 불편감을 주소로 방문한 55세 남자 환자의 초음파 검사에서 이질성 에코의 거대 신장종괴를 발견하였고 종괴 내부에 중심부 별 모양 반흔의 국소 저에코 병변이 관찰되었다. 혈류 영상에서는 특징적인 종양 주변부 혈류와 중심부로 유입되는 spoke wheel pattern의 양상을 나타내었다. CT 검사에서는 동맥기 조영증강 소견과 지연기 조영감소 소견이 관찰되어 수술 전 진단으로 신세포암을 생각하였다. 그러나 수술 후 병리 검사에서 호산성과립세포종으로 최종 진단된 증례를 보고하고자 한다.
Trans Abstract
With the increasing use of ultrasonography, renal incidentaloma cases have also been rising. A solid renal mass observed incidentally will either be malignant or benign. Of malignant renal tumors, renal cell carcinoma (RCC) is the most common. The two most common benign tumors that need to be differentiated from RCC are oncocytoma and angiomyolipoma. It is difficult to differentiate benign from malignant tumors on ultrasonography. Furthermore, there are also difficulties distinguishing oncocytoma from RCC due to the nonspecific clinical presentation and overlapping imaging findings. Thus, renal oncocytomas are often removed by nephrectomy despite their benign nature. We report the case of a tumor that was suspected to be RCC preoperatively on ultrasonography and computed tomography but was diagnosed as oncocytoma postoperatively.
서 론
최근 초음파 검사에 대한 접근성이 용이해지면서 신장종괴의 발견이 증가되고 있다[1]. 신장의 고형종괴는 양성 종양과 악성 종양으로 나누어지고 악성 종양 중에서는 신세포암(renal cell carcinoma)이 가장 많은 부분을 차지한다[1]. 신세포암과 감별을 해야 하는 가장 흔한 양성 종양에는 호산성과립세포종(oncocytoma)과 혈관근지방종(angiomyolipoma)이 있다[2]. 회색조 초음파 검사만으로는 양성 종양과 악성 종양을 감별하는 데에 한계가 있다. 이때 color Doppler flow image (CDFI)와 microvascular image (MVI)를 통해서 신장종괴 내부의 증가된 혈류 소견을 파악하게 되면 악성 종양의 가능성이 높아지게 되며 가장 먼저 신세포암을 의심해 볼 수 있다. 한편 양성 종양 중 호산성과립세포종의 경우에도 과혈관성 종양으로 보일 수 있기 때문에 초음파 영상과 혈류 소견만으로 신세포암을 확신하기 어려운 경우가 있다. 실제로 수술 전에 실시한 초음파 검사와 전산화단층촬영(computed tomography, CT) 등의 영상 진단에서 신세포암으로 진단되었다가 수술 후에 양성 종양으로 진단되는 경우가 드물지 않다[3]. 저자는 55세 남자 환자에서 회색조 초음파 영상과 함께 CDFI, power Doppler, MVI 검사를 통해서 우측 신장에 발견된 거대 고형종괴의 양상과 종양의 혈류 소견을 파악하여 과혈관성 신세포암을 의심하였고, 수술 전 CT 검사에서 신세포암으로 추정하였으나 수술 후에 호산성과립세포종으로 최종 진단된 증례를 문헌 고찰과 함께 보고하고자 한다.
증 례
55세 남자 환자가 상복부 불편감으로 방문하였다. 이학적 검사에서 우측 상복부에 종괴가 촉지되었고 혈액 검사에서는 특이 소견이 없었다. 촉지된 종괴의 성상을 확인하기 위해서 일차적으로 초음파 검사를 실시하였다.
복부 초음파 검사에서 우측 신장에 10 cm 크기의 경계가 분명한 난원형의 거대 종괴가 있었고 신피질과 비교하여 종괴의 에코 정도는 다소 높고 중심부에 저에코 부분이 발견되었다. 중심부 저에코 부분은 중심부 별모양 반흔(central stellate scar)에 의한 소견으로 보인다(Fig. 1A). CDFI에서 종괴 주변을 감싸는 혈류와 종괴 중심부로 유입되는 혈류 소견이 있었고(Fig. 1B), power Doppler flow image (PDFI)에서 CDFI 영상과 비슷한 혈류의 양상을 보이나 좀 더 명확한 혈류의 양상을 확인할 수 있었다(Fig. 1C). 종괴의 주변부를 감싸는 혈류와 종괴 주변부에서 종괴의 중심으로 진행하는 혈류의 양상을 spoke wheel pattern 이라고 하고 이는 호산성과립세포종의 특징적인 혈류 소견이다. MVI 검사에서는 종괴 주변의 혈류뿐만 아니라 CDFI, PDFI 영상에서 명확하지 않던 종괴 내부의 미세한 혈관상도 확인할 수 있었다(Fig. 2). CT 검사에서는 동맥기에 조영이 증가되는 거대 과혈관성 종괴와 중심부의 별 모양 반흔을 보이고 지연기 영상에서는 조영감소의 양상을 보였다. 정상 신장조직은 주변 부위로 밀려나 있는 상태였다(Fig. 3). 이러한 영상 소견은 신세포암의 소견과 감별이 어렵고 중심부의 저밀도 병변은 신세포암의 중심부 괴사 소견과 감별이 쉽지 않다.
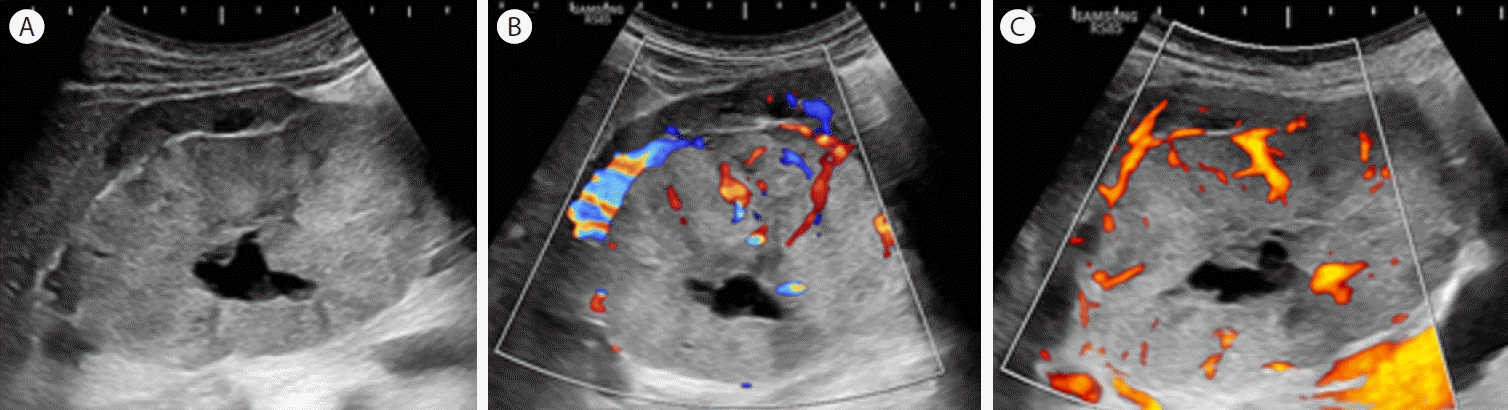
Transabdominal ultrasonography. (A) A huge, well-demarcated heterogeneous mass with a central hypoechoic area (central stellate scar) in the right kidney. (B) Color Doppler flow imaging shows a peripheral rim of vessels with centripetal radiating vessels forming a spoke wheel pattern. (C) Power Doppler demonstrates the prominent vascularity of the tumor.

Microvascular imaging (MVI). (A) MVI shows numerous small, thin vessels and peripheral circumferential vessels. (B) Spoke wheel vascular pattern.

Abdominal computed tomography (CT) scan. (A) Non-contrast image shows a huge heterogeneous mass in the right kidney. (B, C) The Cortiomedullary and nephrographic phase of CT show peripheral enhancement of mass with a central non-enhancing hypodense stellate scar in the right kidney. (D) Excretory phase of CT shows a washout of contrast from the periphery of the mass.
저자는 초음파 검사에서 과혈관성 신장종괴를 발견하였을 때 신세포암을 가장 먼저 의심하였고 spoke-wheel pattern의 혈류 소견은 단순히 증가된 종괴 내 혈류 소견으로, 중심부 저에코 부분은 신세포암의 중심부 괴사로 판단하였다. 이어서 실시한 CT 검사에서도 동맥기 조영증강 소견과 지연기 조영감소의 양상 등 신세포암을 시사하는 소견이 확인되어 상급병원으로 전원하였다. 환자는 신장적출술이 시행되었으며 수술 후 최종 병리 검사에서는 호산성과립세포종으로 최종 확인되었다.
고 찰
초음파 검사의 접근성이 용이해지면서 신장 우연종(incidentaloma)의 발견이 증가되고 있으며 이렇게 발견되는 고형 신장종괴의 대부분은 신세포암이므로 정확한 진단이 필요하다[2]. 악성 종양 중에는 신세포암이 가장 많고 양성 종양 중에는 호산성과립세포종과 혈관근지방종이 대부분을 차지한다[1]. 신장종괴를 조기에 발견하고 양성 종양과 악성 종양을 감별해 주는 것이 조기에 치료 방향을 결정하고 예후를 예측하는 데 있어서 아주 중요하다. 초음파 검사가 이러한 신장종괴를 찾아내는 데 접근이 용이한 첫 번째 검사가 되고 있다[2].
신장종괴는 초음파 검사에서 다양한 크기와 모양 및 echogenicity로 발견되므로 신장종괴의 에코 정도와 모양만으로 악성과 양성을 감별하기는 어렵다. 가장 흔한 신장실질 종양은 신세포암으로 신장 악성 종양 중에서 90%를 차지한다[4]. 신세포암의 초음파 소견은 일반적으로 등에코 소견을 보이고 있으나 저에코 혹은 고에코로 보일 수도 있으며 조직의 괴사가 동반되는 경우에는 병변 내부에 저에코 소견이 나타날 수도 있다. 도플러 검사에서는 혈류신호가 증가된 과혈관성 병변으로 관찰된다[5].
호산성과립세포종은 모든 신장종양의 3-7%를 차지하는 고형성의 양성 신장종양이다[6]. 대부분의 경우에 아무런 증상이 없이 우연히 발견이 된다[7]. 신장의 호산성과립세포종은 양성의 임상 경과를 가지고 있으며 장기간의 예후는 상당히 우수하다[8]. 호산성과립세포종은 다른 종류의 신장종괴와 영상 소견이 유사하기 때문에 수술 전에 진단이 어렵고[3], 많은 경우에 있어서 호산성과립세포종은 신세포암과 감별이 어렵기 때문에 신적출술 후에야 진단이 된다[6]. 특징적인 영상 소견은 단발성의 고형 종괴이고 명확한 경계를 가지고 있으며 캡슐이 없는 균질성 종양이다[3]. 호산성과립세포종은 원형이나 난원형이며 신실질과 비교하여 등 에코 소견이거나 다소 고에코 양상을 보인다. 별 모양 중심부 반흔이 호산성과립세포종의 특징적인 영상 소견이 될 수 있다[6]. 별 모양 중심부 반흔은 종괴의 중심에서 주변부로 가지를 치는 모양의 저에코 초음파 소견인데 CT 영상에서도 비슷한 모양의 중심부 반흔이 나타날 수 있다. 별 모양 중심부 반흔은 주로 종괴의 크기가 큰 경우에 나타나는 소견이고 호산성과립세포종 증례의 약 1/3에서 나타나는 소견이지만 신세포암에서 관찰되는 중심부 괴사의 영상과 유사하기 때문에 감별에 주의가 필요하다[7]. CDFI 영상에서 종양 주변을 감싸는 혈류와 종양 주변부에서 중심부로 유입되는 혈류의 모양을 나타내는 spoke wheel pattern도 호산성과립세포종을 진단하는 데 도움을 주는 특징적인 소견이 된다[1]. 그 외에 신세포암과 비교하여 볼 때 신장 주변조직으로의 침윤이 없고 혈관침범이 없으며 원격전이 소견이 없다는 것이 호산성과립세포종을 시사하는 소견이 된다[7]. 호산성과립세포종의 CT 영상 소견은 경계가 명확한 균질성 과혈관성 종괴의 소견이면서 동맥기에 조영증강이 되고 지연기에 조영감소를 보인다. 초음파와 마찬가지로 CT에서도 종괴가 큰 경우에는 별 모양의 중심부 반흔이 나타날 수 있다[2]. 이것은 호산성과립세포종의 진단에 도움을 주는 중요한 소견이기는 하나 신세포암에서 보이는 종괴 내 중심부 괴사와 구별이 어려울 수 있다[9].
호산성과립세포종은 수술 전에 정확하게 진단이 되었다면 신장의 전절제술을 피하거나 국소절제술 만으로도 치료가 가능하다. 그러나 초음파 검사 및 CT 검사에서 신세포암과의 감별이 어렵기 때문에 부득이 신장의 전절제술로 진행이 되고 수술 후에야 비로소 호산성과립세포종으로 진단되는 경우가 있다. 고형 종괴의 발견시 특징들을 잘 찾아내어 악성 종양으로부터 양성 종양을 감별해낼 수 있다면 이러한 불필요하거나 과도한 수술을 줄이는 데 도움이 된다[9]. 신장의 고형 종괴를 진단할 때는 악성 종양인 신세포암뿐만 아니라 양성 종양의 가능성도 항상 고려해서 판단하는 것이 환자의 치료와 예후를 결정하는 데 중요하다.