서 론
췌장의 고형성 병변은 정확한 진단과 향후 치료에 대한 방침을 설정하는데 아직까지 많은 어려움이 있는 실정이다. 조영증강 내시경 초음파(contrast-enhanced endoscopic ultrasound, CEH-EUS)는 도플러에 의한 인공음영 없이 조영제 주입 후 조영제에 특화된 영상기법인 하모닉 영상을 얻음으로써 췌장 실질의 관혈류뿐만 아니라 역동적인 미세순환의 탐색까지 가능하도록 해주었다[1]. 최근 여러 연구에서 췌장의 악성 및 양성 병변의 평가에 있어 조영증강 내시경 초음파의 유용성에 대해 보고하였다[2-4]. 조영증강 내시경 초음파는 췌담도질환에서 점점 그 중요성을 더해가고 있으며 우리나라에서도 점점 그 활용도가 증가하고 있다.
췌장 고형성 병변의 표준 진단 방법은 수술 또는 초음파내시경 유도하 세침 흡인(EUS-guided fine needle aspiration, EUS-FNA)을 통해 획득한 조직학적 검체의 병리학적 진단이다. 그러나 EUS-FNA을 통한 진단은 흡입 검체내 불충분한 종양세 포수, 응고장애와 같은 검사의 금기사항에 해당되는 경우가 있어 진단에 많은 어려움이 있다. 그러므로 조영증강 내시경 초음파는 비침습적으로 수행할 수 있다는 장점으로 인해 악성 종양을 감별하는데 전도 유망한 검사 방법이다. 저자들은 2010년부터 췌장 고형성 병변이 있는 환자를 대상으로 하여 전향적으로 조영증강 내시경 초음파검사를 시행하였다. 이번 연구의 목적은 췌장 미세혈관 및 순환 영상을 통해 여러 종류의 췌장 고형성 병변부터 췌장암을 감별하는데 있어 조영증강 내시경 초음파의 정확도 및 유용성에 대해 평가하고자 한다.
대상 및 방법
대상
2010년 12월부터 2012년 6월까지 췌장 고형성 병변이 있는 37명의 환자를 대상으로 B-mode 내시경 초음파와 조영증강 내시경 초음파를 이용하여 전향적으로 진단하였다. 이 연구는 연구 윤리 위원회의 승인을 받았다.
조직학적으로 확실하게 진단된 고립된 췌장 고형성 병변을 가진 환자를 연구대상으로 하였다. 췌장 고형성 병변은 복부 초음파, 복부 전산화단층촬영(computed tomography) 또는 자기공명영상진단(magnetic resonance imaging, MRI) 검사에서 처음으로 발견되었다.
본 연구에서 낭성 성분이 병변 총 용적의 50% 이상을 차지하는 경우, 임신, 수유, 18세 미만 그리고 SonoVue (Bracco, Milan, Italy) 투여가 금기인 환자의 경우는 연구대상에서 제외되었다.
내시경 초음파와 조영증강 내시경 초음파 표준 수기
B-mode 내시경 초음파와 조영증강 내시경 초음파는 통상적으로 사용되고 있는 방사형 내시경 초음파 기계(GIF-UE260; Olympus, Tokyo, Japan)를 이용하였다. 초음파 분산기는 Aloka α-10 (Aloka Co., Ltd., Tokyo, Japan)을 사용하였다. 내시경 초음파 검사는 meperidine과 midazolam을 사용하여 의식하 진정 상태에서 시행되었다. 모든 연구대상 환자는 조영증강초음파 시행 전 고식적 B-mode scanning을 시행하여 병변의 위치, 크기 및 특징을 기술하였다.
B-mode로 전체 췌장을 빠짐없이 관찰한 후, 내시경 초음파를 조영증강 방식으로 변경하고 조영제로 SonoVue를 정맥주입하였다. 조영증강 내시경 초음파는 3.4 MHz의 고주파를 이용한 하모닉 감지 방식으로, SonoVue 2.4-mL를 정맥주입 후 즉시 내시경 초음파를 시작하였다. 첫 검사에서 결론이 도출되지 않을 경우 두 번째 용량으로 SonoVue 2.4-mL를 주입하였다.
병변을 관찰하기 위해 췌장의 전면부에 내시경 초음파를 위치시키고, 실시간으로 전체 병변을 확인하였다. 동맥기와 정맥기를 완벽하게 관찰하기 위해 SonoVue 주입 후 150초 동안 검사가 이루어졌다. SonoVue 주입 후 30초를 조영 초기, 30초에서 120초까지 조영 후기로 간주하였다.
조영증강 내시경 초음파 영상은 디지털 비디오 시스템으로 녹화되었고 3명의 내시경 전문의들이 영상 결과를 평가하였다. 모든 췌장 병변에서 췌장 주변 조직과 비교하여 혈관분포도를 평가하였고, 조영증강 내시경 초음파 영상을 기초로 조영 초기와 후기 단계에서 저혈관성, 등혈관성, 과혈관성으로 분류하였다. 저자들은 조영 초기와 후기에서 혈관 분포도에 따른 조영증강의 변화를 세 가지 유형으로 분류하였다; type Ⅰ (persisted hypovascular pattern in the early and late phase), type Ⅱ (isovascular or hypervascular in the early phase and hypovascular in the late phase), type Ⅲ (isovascular or hypervascular in the early phase and isovascular or hypervascular in the late phase). 이 세 가지 유형은 수술 또는 EUS-FNA를 통해 밝혀진 최종 진단과 비교 분석하였다. 또한 췌장 고형성 병변과 정상조직의 조영증강 특징(fast, simultaneous 또는 slow), 조영소실 특징(fast or slow washout)과 분포양상(균질성, 비균질성) 등을 비교 기술하였다.
결 과
췌장의 고형성 병변을 가진 37명의 환자들이 연구대상에 포함되었다(24 males, 13 females; mean age 62.3 ± 13.3 years; range 24 to 82 years). 병변의 평균 크기는 3.4 ± 0.8 cm (range 1.7 to 5.6 cm)였다. 병변의 위치는 췌장 두부 20명, 체부 10명, 미부가 7명이 포함되었다. 최종 진단은 췌장 선암종(pancreatic adenocarcinoma) 27, 신경내분비종양(neuroendocrine tumor, NET) 4, 침윤성 췌관내 유두상 점액성 종양(invasive intraductal papillary mucinous neoplasm, invasive IPMN) 2, 국소 췌장염(focal pancreatitis) 2, 선방세포암종(acinar cell carcinoma) 1, 췌장결핵(pancreatic tuberculosis) 1로 보고되었다. 26명의 환자에서 EUS-FNA 검사로, 10명의 환자는 수술적 방법, 나머지 1명은 두 가지 방법 모두를 통해 조직학적 검체를 얻었다. 1명의 췌장선암종 환자에서 EUS-FNA 검사는 조직학적 진단에 불충분하였다. 이 환자의 경우 수술을 통해 병리학적 진단을 얻을 수 있었다. 수술적 병리 또는 EUS-FNA를 통한 최종 진단을 Table 1에 정리하였다. 고식적 B-mode 내시경 초음파에서 췌장 고형성 병변은 고에코(n = 2), 등에코(n = 2), 또는 저에코(n = 33) 소견을 보였다.
췌장 병변과 주변 정상 췌장의 미소혈관계는 SonoVue 정맥주입 후 하모닉 영상 기법을 사용하여 관찰하였고 1명의 환자에서 4.8-mL SonoVue 주입이 필요하였다. SonoVue 주입과 관련된 합병증은 없었으며 초음파 영상의 해석은 모든 환자에서 가능하였다.
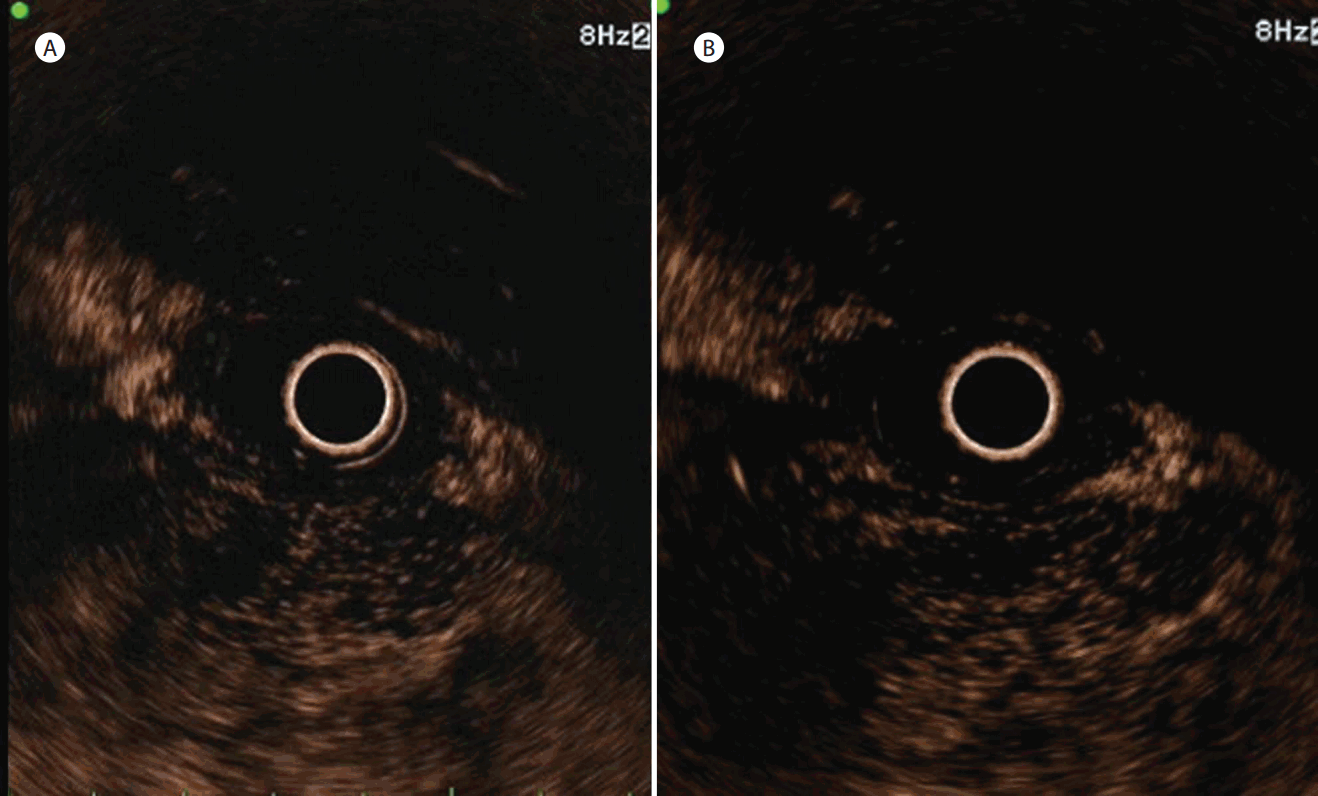
췌장 선암(Fig. 1), 침윤성 IPMN 그리고 선방세포암종(Fig. 2)을 포함한 원발성 췌장암이 가장 많은 빈도를 차지하였다(81%). 최종 진단과 조영증강 내시경 초음파 영상을 비교하였을 때 30명의 췌장암 중 28명의 환자에서 조영 초기 조영감소를 보였다(Table 2). 1명의 췌장암 환자는 조영 초기 등강도의 조영증강을 보이다가 후기 조영감소로 나타났다. 또 1명의 선방세포암종 환자는 비균질한 조영감소를 보였다. 벽 결절을 가진 침윤성 IPMN의 경우 결절에서 가지 양상의 조영증강, 낭벽은 조영감소를 보였고, 벽 결절이 없는 IPMN의 경우 낭벽에서만 조영감소를 보였다. 30명의 췌장암 중 28명(94%)에서 type Ⅰ (persisted hypointensity)을 보였다. 종양의 조영증강 속도는 30명 중 26명(87%)의 췌장암에서 췌장 주변 조직보다 지연 조영증강되는 양상을 보였다. 또한 30명의 췌장암 환자 중 28명(94%)에서 fast washout을 보였고, 28명에서 비균질한 조영증강 분포를 보였다. EUS-FNA에서 위음성 결과를 보인 1명의 췌장 선암 환자에서 조영증강 내시경 초음파 상 저강도 소견을 보여 악성 종양의 감별진단에 도움이 되었다.
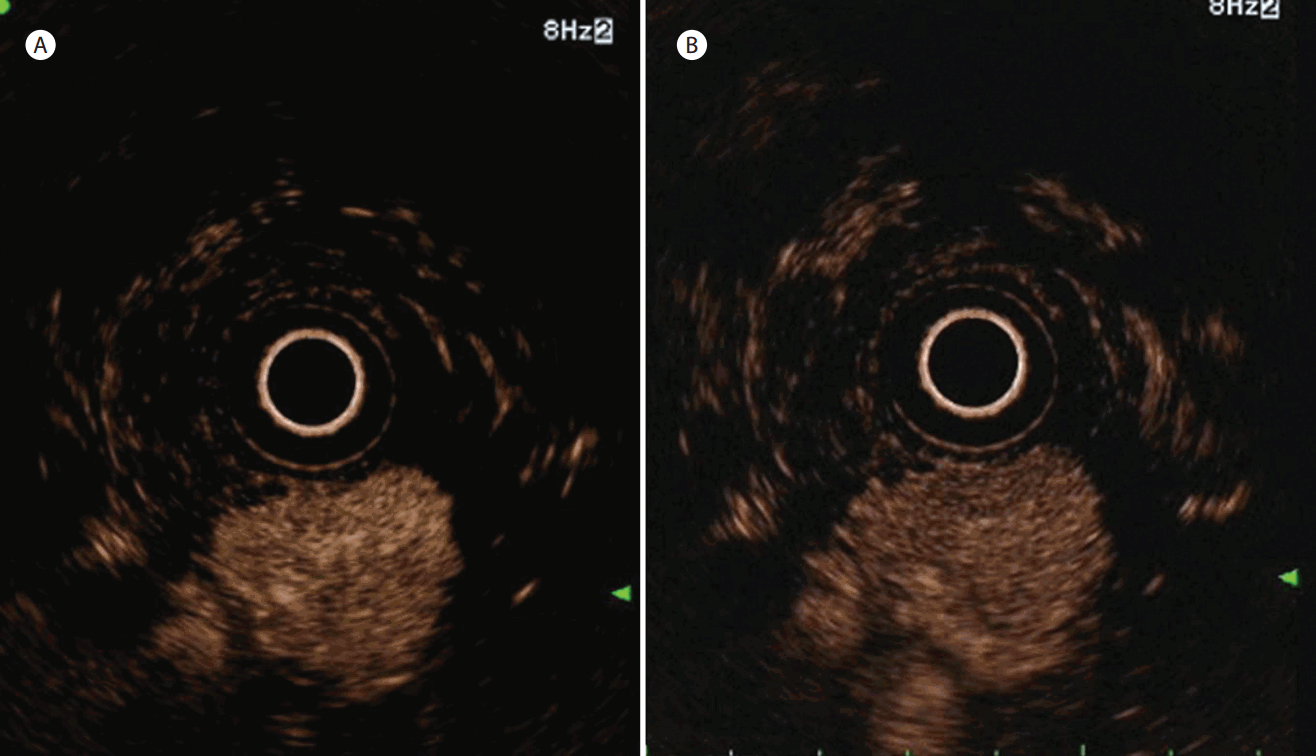
4명의 NETs (Fig. 3) 모두 조영 초기 고강도의 조영증강을 보였고 3명에서 조영 후기에도 지속적으로 조영증강 상태가 유지되었다(Table 2). 모든 NETs에서 조기 조영증강을 보였고, 3명의 경우 slow washout 양상과 균질한 조영증강 패턴을 보였다. 1명의 췌장 결핵 환자는 조영 초기 고강도의 조영증강과 조영 후기 등강도를 보였다(Fig. 4). 국소 췌장염의 경우 2명의 환자 모두에서 조기 및 후기 등강도를 보였다. 3명의 염증성 병변 중 2명에서 주변 췌장조직과 같은 속도로 조영증강되는 패턴을 보였고, 모든 염증성 병변에서 균질하고 slow washout 패턴을 보였다. 모든 NETs와 염증성 병변은 type III (isointense or hyperintense to isointense or hyperintense) 양상을 보였다.
췌장암의 특징으로서 저혈관성 음영은 민감도 93%, 특이도 86%, 양성예측도 93%, 음성예측도 74% 그리고 정확도 92%로 분석되었다. 췌장 악성 종양 이외의 진단에 있어서 고강도 또는 등강도의 조영증강 소견은 민감도 86%, 특이도 93%, 양성예측도 75%, 음성예측도 96% 그리고 정확도에서 92%를 보였다.
고 찰
췌장 고형성 병변은 고식적인 영상의학적 기법으로 감별진단이 어려운 경우가 종종 있다. 내시경 초음파는 작은 췌장 병변에 대해 높은 민감도를 보이지만, 췌장암과 양성 췌장 종양을 구별하는데 있어서 아직 많은 제한점이 있다[5]. 최근 조영증강 내시경 초음파가 소개되고 다양한 췌장 병변의 평가가 가능해졌다. 조영증강 기법으로 정상 조직과 병적인 췌장 조직의 혈류와 혈관분포 양상 등의 정보를 얻을 수 있게 되었다[6].
아직까지 췌장 고형성 병변의 감별진단에 있어 조영증강 내시경 초음파의 유용성에 대한 연구는 한국에서 보고된 바 없다. 본 연구에서 연구대상자는 비교적 적었지만 조영증강 내시경 초음파가 췌장 고형성 병변의 특징을 정의하는데 있어 유용한 검사라는 것을 제시하였다. 본 연구에서 조영증강 내시경 초음파 검사를 이용한 췌장암 진단의 민감도, 특이도, 정확도는 각각 93%, 86% 그리고 92%로 나타났다. 이 결과는 이전 해외에서 보고된 여러 연구들과 큰 차이가 없었다(민감도 82-97%, 특이도 89-100%).
그러나 본 연구에서는 조영증강 내시경 초음파검사를 이용하여 국소적인 췌장 병변의 감별진단에도 추가적인 정보를 제공하였다. 이전에 보고된 연구들은 선형 내시경 초음파를 사용하였지만[4,7], 저자들은 방사형 내시경 초음파를 이용하였다. 선형 내시경 초음파는 단순 초음파 영상 외에도 컬러도플러와 높은 조직 해상도를 제공해 준다는 장점이 있다. 하지만 최근에는 새로운 전자식 방사형 내시경 초음파 또한 선형 방식과 같이 컬러도플러와 고해상도의 화상을 얻을 수 있어 이러한 차이가 없어지고 있다[8]. 게다가 방사형 내시경 초음파는 CT 영상과 유사한 단면 영상을 얻을 수 있고, 360° 화상을 보여주기 때문에 시야가 넓고 주위 구조를 이해하기가 쉬운 장점이 있다. 본 연구의 결과 조영증강 내시경 초음파에서 방사형 기법이 선형 기법과 비교하여 열등하지 않다는 것을 보여주었다.
저자들은 대부분의 췌관 선암종에서 내부는 비균질하고 저혈관성 에코를 보이는 전형적인 조영증강 패턴을 관찰하였다. 또한 대부분의 NETs는 균질하며 과혈관성 에코를 보이고, 염증성 병변에서는 균질하며 등혈관성 또는 과혈관성 에코의 조영증강 패턴을 관찰하였다. 저자들은 조영 초기 조영증강의 정도가 대부분의 환자에서 조영 후기까지 지속된다는 것을 발견하였다. 30명의 췌장암 중 28명(94%)에서 저혈관성 에코가 지속되었고, 4명의 NETs 중 3명(75%)에서 과혈관성 에코가 지속되었으며, 3명의 염증성 병변 중 2명(67%)에서 등혈관성 에코가 지속되었다. 따라서 조영증강 정도의 변화뿐만 아니라 조영 초기 조영증강 정도의 지속 여부가 췌장 고형성 병변의 감별진단에 중요한 정보를 제공해 줄 것으로 보인다.
조영증강 내시경 초음파는 췌관 선암종을 감별하는데 유용하지만, NET와 양성 췌장 종양은 모두 등혈관성 또는 과혈관성 에코 양상을 보였기 때문에 감별하기가 쉽지가 않다[9]. 저자들은 조영증강 그리고 조영소실 속도가 악성 종양, NET, 염증성 병변에서 차이가 있는 것을 발견하였다. 대부분의 악성 종양(26/30, 87%)은 정상 췌장조직보다 더 천천히 조영증강되었고, 염증성 병변(2/3, 67%)에서는 주변 췌장조직과 비슷한 속도의 조영증강 양상, NETs (100%)에서는 주변 췌장조직보다 더 빠른 속도로 조영증강이 되었다. 30명의 악성 종양 중 28명(93%), 3명의 염증성 췌장 병변 모두에서 fast washout이 관찰된 반면, 4명 중 NETs는 3명 모두에서 slow washout 양상을 보였다. Fusaroli 등[2]은 대부분의 췌장암과 염증성 병변에서 fast washout을 보이고, NET는 slow washout을 보인다고 보고하였다. 그러므로 감별진단이 쉽지 않은 등혈관성/과혈관성 에코를 보이는 종양성 병변에서, 정상 조직에 비해 빠른 조영증강과 slow washout을 보이는 것은 NET를 암시하고, 동시 발생의 조영증강을 보이면서 fast washout을 보이면 염증성 병변을 의심해 볼 수 있다.
그럼에도 불구하고 모든 췌장 외분비암 중 10%를 차지하는 췌관 선암종 이외의 외분비암은 전형적인 영상 소견을 기술하는데 있어 많은 논의가 필요한 실정이다. 저자들은 1명의 선방세포암종과 2명의 IPMNs에서 저혈관성 에코를 보이며, 주변 정상 조직에 비해 천천히 조영증강되며 fast washout 양상을 보이는 것을 발견하였다. 이전에 보고된 두 가지 연구에서 선방세포암종(n = 4)은 조영증강초음파에서 비균질한 조영증강을 보였다[10,11]. 본 연구에서는 선방세포암종은 비균질한 양상의 저혈관성 에코 양상의 조영증강을 보였는데 연구대상 환자가 1명뿐 이어서 이전 연구들과 차이를 설명하기는 어렵다. 침윤성 IMPN의 경우, 이전 연구들에서 낭벽은 조영감소를 보이고 벽결절은 가지 모양의 조영증강 패턴을 보였다[12,13]. Kurihara 등[13]은 IPMN에서 가지 양상의 병변을 보이는 경우 악성 종양과 연관이 있다고 보고하였다. 마찬가지로 본 연구에서도 벽 결절을 가진 1명의 침윤성 IPMN에서 가지 모양의 조영증강은 가진 벽 결절과 낭벽의 조영감소 소견을 보였다.
요컨대, 본 연구는 조영증강 내시경 초음파가 췌장 고형성 병변의 감별진단에 유용한 검사 방법이라는 것을 증명하였다. 조영증강 하모닉 내시경 초음파는 조영 조기 및 후기 미세혈관순환, 조영증강의 속도, 조영소실 패턴 등을 평가함으로써 췌장 선암을 구별하고, NET와 염증성 병변의 감별진단하는데 유용한 검사 방법으로 이용될 수 있을 것으로 사료된다. 추후 췌장 고형성 병변의 평가에 있어 조영증강 내시경 초음파의 임상적 역할에 대해 대규모의 전향적 연구가 필요할 것으로 판단된다.