일반 의사를 위한 주의해야 할 성인 선천성 심장 질환 초음파 영상
Abstract
The population of adults with congenital heart disease (CHD) is increasing not only from de novo adult diagnostic cases but also due to successful pediatric medical and surgical interventions decades earlier. Most adults with CHD are followed-up in specialized pediatric cardiology or adult congenital heart clinics, but it is not uncommon for such adults to be seen in general echocardiographic practice, so understanding adult CHD in detail is becoming an essential general echo requirement. This review covers how to approach CHD in a structural manner and the real pitfall cases we’ve actually met in daily practice.
Keywords: Congenital heart disease; Echocardiography
중심 단어: 선천성 심장 질환; 심장 초음파
서론
성인에서의 선천성 심장 질환(congenital heart disease, CHD)은 출생 시부터 문제가 되는 심장의 해부학적, 생리학적 이상소견뿐만 아니라, 경우에 따라 시술 또는 수술로 인한 변형도 함께 존재할 수 있는 이질적인 질환 군이다[ 1]. 선천성 심장 질환의 유병률은 대략 생존 출생의 1%에 달하지만[ 2], 출생 1년 이내에 교정이 필요하고, 중대한 선천성 심장 질환은 이 중 약 25%를 차지한다. 내과적 및 외과적 치료의 발전으로 중대한 선천성 심장 질환 환아에서도 18세 이상 생존율이 90%에 육박하면서[ 3], 성인 선천성 심장 질환의 유병률은 점차 증가되고 있는데, 최근 보고에 따르면 인구 100만 명당 3천 명 정도로 추산된다[ 4]. 이에 일반 성인 심초음파 검사를 수행하는 의사들도 확률상 만나게 될 가능성이 커진 선천성 심장 질환에 대한 접근법을 나름대로 재정립할 필요가 있다. 본 종설은 일반 클리닉에서 성인 선천성 심장 질환 심초음파를 보게 되는 의료인의 입장에서 임상적 및 구조적 접근을 설명하고, 실제 리포트에 오류가 있었던 여섯 증례를 공유하면서 함정에 빠질 수 있는 초음파 영상 포인트들을 짚어보고자 한다.
본론
심초음파 검사는 성인 선천성 심장 질환의 진단과 치료에 있어서 Class I 권고 사항이다[ 1]. 임상적으로 성인 심초음파 검사 시 볼 수 있는 선천성 심장 질환 환자의 유형은 임상적으로 크게 세 부류이다. 첫째, 성인이 되어 처음으로 선천성 심장병을 진단받게 된 환자이다. 둘째, 어릴 때 선천성 심장병을 진단 받아 이미 알고 있었으나 수술적 교정 없이 성인이 된 환자이다. 경한 병변이었기 때문에 수술 적응증이 되지 않아서 성인이 될 때까지 관찰하고 있는 환자 혹은 너무 심한 병변으로 수술이 어려운 아이젠멩거증후군 환자가 이에 해당한다. 셋째, 이미 시술이나 수술을 받은 환자이며, 대부분 성인에서 만나는 선천성 심장병 환자들이 이에 속한다[ 5]. 이들 중에는 치료 이후 완치된 경우도 있지만, 교정은 하였지만 지속적인 경과 관찰이 필요한 경우도 많다[ 6]. 해부학적인 완전한 교정이 아니라 기능적으로 교정한 단심실 생리를 가진 환자, 폰탄형 수술을 받은 환자는 성인이 되어 발생될 수 있는 심부전, 판막 역류증을 잘 관찰하여야 한다. 대표적인 예로 완전 교정된 팔로네징후(Tetralogy of Fallot, TOF)에서 잘 나타나는 폐동맥 판막 역류는 청소년기에 걸쳐 적절한 수술적 교정 시기를 결정해 주어야 한다[ 7]. 가장 잘 알려진 선천성 심장 질환의 구조적 분류법은 단순 심기형(simple CHD)과 복합 심기형(complex CHD)으로 나누는 것이다[ 1]: 단순 심기형: 심방 중격 결손증(atrial septal defect, ASD), 심실 중격 결손증(ventricular septal defect, VSD), 동맥관개존증(patent ductus arteriosus, PDA), 엡스타인 기형(Ebstein’s anomaly) 등; 복합 심기형: TOF, 대혈관 전위증(transposition of the great arteries, TGA). 또 다른 구조적 분류법으로 선천성 심장 질환을 구조적 연결의 관점에서 아래와 같이 두 분류로 나누는 방법이 있는데, 성인 심초음파 검사를 수행하는 의사의 입장에서 도움이 되는 접근법이다( Table 1). 첫째, 심방, 심실, 판막, 대혈관의 연결이 정상적인 경우에는 어떤 병변이 주된 것인가에 따라서 단락 중심, 협착 중심, 판막의 위치이상으로 구분하여 병변에 접근하는 것을 추천한다. 둘째, 심방, 심실, 판막, 대혈관의 연결이 비정상적인 경우에는 주된 병변이 심방-심실 연결이상인지, 심실-대혈관 연결이상인지를 따져 보아야 하는데, 이러한 경우가 의심되면 선천성 심장 질환 전문 센터에 의뢰하는 것을 추천한다.
성인 선천성 심장 질환: 함정에 빠질 수 있는 영상
이차공 심방 중격 결손으로 오인된 증례
두근거림을 주소로 내원한 19세 남자가 경흉부 심초음파 검사를 받았고, 이차공 심방 중격 결손(secundum ASD)이 의심되었다. 2D 영상에서 결손 크기 직경 13 mm로 측정되어 있었고, 다른 심장의 구조나 기능적 이상 소견은 없었다( Fig. 1). 결국, 환자는 정상 심방 중격으로 판단되었다. 이와 같이 특히 젊은 사람에서 심방 중격이 얇은 경우 2D 초음파 영상에서 마치 결손이 있는 것으로 오인될 수 있는데, 이때 컬러도플러 기법이 도움이 되며 혈류가 심방 중격을 넘어가지 않고 중격을 타고 올라가는 영상을 획득한다면 정상 심방 중격으로 확진할 수 있다.
일차공 심방 중격 결손으로 오인된 증례
호흡곤란을 호소하며 내원한 62세 남자가 경흉부 심초음파에서 좌-우 단락으로 심방 중격 결손이 의심되어 경식도 심초음파 검사를 받았다( Fig. 2A). 결손의 위치가 가장 흔한 형태인 심방 중격의 중앙 부위 난원공(fossa ovalis)보다 아래쪽에 가까워서, 초음파 판독에는 일차공 심방 중격 결손(primum ASD)를 의심한다고 적혀 있었다. 증례는 이차공 심방 중격 결손(secundum ASD)이며( Fig. 2A), 전혀 다른 병태생리를 가진 일차공 심방 중격 결손과의 차이를 숙지할 필요가 있다( Fig. 2B). 일차공 심방 중격 결손(primum ASD)은 심내막 쿠션 결함(endocardial cushion defect)의 일종으로서, 부분 방실 중격 결손(partial atrioventricular septal defect [partial AVSD], partial atrioventricular canal defect)이라고도 부른다. 완전 방실 중격 결손(complete AVSD)과 달리 심실 중격 결손이 없기 때문에 단순 심방 중격 결손과 유사하게 보이지만, 방실 판막(atrioventricular valve)의 해부학적 구조를 보면, 자라난 조직이 공통 방실 판막(common atrioventricular valve)을 둘로 나누면서 승모판막 개열(cleft mitral valve)을 형성하고, 승모 판막 역류를 야기하게 된다( Fig. 2B). 방실 중격 결손 환아의 경우, 증상이 경하다고 할지라도 6개월-3세의 나이에 수술적 교정을 받게 되는 경우가 대부분이며, 부분 방실 중격 결손 수술을 1.5세에 한 경우 경과가 좋았다는 보고가 있다[ 8].
막양부 심실 중격 결손이 작게 평가된 증례
최근 심해진 감기 증상과 동반한 호흡곤란으로 병원을 방문한 19세 여자로, 출생 당시 선천성 심장병(심실 중격 결손증) 진단을 받았는데, 4세까지는 소아청소년과에서 정기적으로 검진받다가 좋아졌다는 말을 듣고 이후에는 병원에 가지 않았다. 신체 검사상 곤봉지가 관찰되었고, 동맥혈 산소 분압 52.7 mmHg, 산소 포화도 88%였다. 당시 시행한 컴퓨터단층촬영(computed tomography, CT) 통상적 단면(routine tomographic plane)에서 심실 중격 결손 크기는 12.7 mm로 측정되어 있었다( Fig. 3A). 다시 수행한 심초음파에서 막양부 심실 중격 결손은 심실 중격 전방 이상 정렬(anterior malalignment)을 보였고, 결손 크기 26 mm, 우-좌 단락 혈류, 그리고 심한 폐고혈압(estimated pulmonary artery systolic pressure 125 mmHg)이 동반되어서, 큰 막양부 심실 중격 결손에 동반된 아이젠멩거증후군으로 판단되었다( Fig. 3B- F). 안타까운 점은 임상적으로 4세 때, 좌-우 단락이 우-좌 단락으로 바뀔 때 결손을 통한 잡음이 줄어든 것을 좋아졌다고 잘못 판단하였을 수 있고, CT상 통상적인 단면에서 결손 크기를 작게 평가하였다는 점이다. 심실 중격 결손에서 심초음파를 통해서 관찰하여야 할 해부학적 소견은 결손의 위치, 크기, 심실 중격의 이상 정렬 여부, 동반 기형 등이다[ 9]. 특히 전방 이상 정렬이 있는 심실 중격 결손의 크기는 상당히 큰데, 통상적인 정형화된 단면들(parasternal long axis and apical 4-chamber views)에서는 결손 크기를 작게 평가할 수 있고, 이로 인해 수술 시기를 놓쳐 아이젠멩거증후군으로 진행될 수도 있으므로 주의해야 한다. 환자의 경우와 같이 우심실 유출로 협착을 유발하지 않는 전방 이상 정렬을 “Eisenmenger type VSD”라 부르기도 한다[ 10].
대혈관 판하 심실 중격 결손으로 오인된 증례
폐동맥 판막 역류는 일반적으로 우심실 유출로를 향하여 제트를 형성하지만, 대동맥 판엽으로 컬러도플러 제트가 걸쳐 보일 때가 있어 대혈관 판하 심실 중격 결손(subarterial VSD)을 의심한다고 판독되었던 영상이다( Fig. 4A). 이는 폐동맥 판막 역류인데, 감별점은 컬러 제트가 대동맥 판막이 닫혀 있는 이완기에 관찰되며, 연속파형 도플러(CW Doppler)에서 탐촉자를 향해 다가오는(부채꼴의 꼭지점을 향하는) 낮은 속도의 이완기 혈류라는 점이다( Fig. 4A). 이와 비교할 수 있도록 실제 대혈관 판하 심실 중격 결손증 환자 영상을 제시하였다( Fig. 4B, C). 연속파형 도플러상 단락을 통한 수축기 혈류를 확인할 수 있고, 특히도플러 빔 각도가 단락을 통한 혈류와 평행되는 흉골 장축 영상(parasternal long axis view)에서 수축기에 5 m/s를 넘는 빠른 좌-우 단락을 잘 평가할 수 있다( Fig. 4C). 무엇보다 선행되어야 하는 것은 청진이라고 사료되며, 작은 대혈관 판하 심실 중격 결손을 통해 수축기에 형성되는 높은 속도의 좌-우 단락은 청진으로 놓치기 어렵다.
심한 폐동맥 판막 역류증을 간과한 증례
어릴 때 선천성 심장병으로 개흉 수술을 받은 과거력이 있는 49세 여자 환자가 최근 심해진 호흡곤란으로 인근 병원에서 심초음파 검사를 받았는데, 초음파 판독지에 폐동맥 판막 역류에 대한 기술은 없었다. 폐동맥 판막은 심장의 네 개 판막 중에서 가장 소홀하게 다루어지기 쉬운 판막이다. 그런데 폐동맥 판막에 꼭 집중해야 하는 경우 하나만 예를 들라고 한다면, 어릴 때 TOF 수술을 받은 성인이다. 좁은 폐혈관을 판막 성형하거나 확장하게 되므로 폐동맥판 역류 소견이 남게 되는데 청소년기에 폐동맥 판막 치환 수술을 받아야 하는 시기를 놓치지 않게 하기 위함이다. 상기 환자는 TOF 수술적 교정을 받은 경우로 심한 폐동맥 판막 역류 소견을 보이고 있었다( Fig. 5). 심한 폐동맥 판막 역류의 특징적인 도플러 소견은 숙지할 필요가 있다. 즉, 컬러도플러상 이완기에 우심실 유출로를 채우는 층류(laminar flow) ( Fig. 5A)와 연속형 도플러 파형에서 기준선 상방 진한 혈류 밀도를 가진 역류 속도가 이완기 말기가 되면 거의 사라지는 소견이 특징적이다( Fig. 5B).
승모판막 역류로 오인된 증례
수년 동안 우심증(dextrocardia)과 승모판막 역류(mitral egurgitation)로 차트에 기록되어 오던 65세 여자 환자가 있었다. 단순 흉부촬영 소견은 심첨부가 우측에 위치하는 우심증인데( Fig. 6A), 신체 검진 및 CT상 간이 우측에 위치하여 심장과 복부 장기의 배열이 모두 좌우가 완전히 뒤바뀌는 거울상 대칭 우심증(mirror image dextrocardia)은 배재할 수 있었고( Fig. 6B), 심초음파 검사를 통해 수정 대혈관 전위(corrected transposition of the great arteries, corrected TGA)로 진단되었다( Fig. 6C). 수정 대혈관 전위는 심방은 정상 위치이면서 심방-심실 간 연결이 부적합(discordant)하고, 심실-대혈관 간 연결도 부적합한 질환인데, 이러한 두 번 꼬이는 해부학적 복잡성에도 불구하고 체정맥이 폐순환과 연결되고, 폐정맥이 체순환으로 이어지는 점은 정상과 같기 때문에, 생리적으로 수정 혹은 선천적으로 수정되어 있는 대혈관 전위로 불리기도 한다(physiologically corrected TGA, congenitally corrected TGA). 심장 판막은 심실의 일부분이므로, 형태적인 우심실(morphologic right ventricle)은 삼첨판막을 갖는다. 환자의 경우는 삼첨판막 이상(Ebstein type)과 삼첨판막 역류를 동반하고 있다( Fig. 6C, D). 즉 수년 동안 승모판막 역류라 기록해 왔던 것은 삼첨판막 역류이며, 무엇보다 형태적인 우심실이 체순환 심실(systemic ventricle)을 담당하게 되는 근원적 문제를 간과해서는 안 된다[ 11].
결론
성인에서 선천성 심장 질환은 더 이상 소수의 심장 전문가 분들만 알아야하는 영역이 아니다. 일차적으로 심초음파 검사를 수행하는 의사가 성인 선천성 심장 질환의 임상적 특징과 구조적 접근법을 숙지함으로써, 심초음파에서 어떤 부분을 중심으로 보아야 하는지, 어떤 경우 선천성 심장 전문 센터로 의뢰해야 하는지 가늠할 수 있을 것이며, 이는 진단 뿐만 아니라 경과 관찰 및 치료의 연속성 측면에서 도움이 될 것으로 사료된다. 성인 선천성 심장 질환에서의 심초음파는 진단적 삼차원 초음파[ 12]로부터 치료적 복합 영상 기법에 이르기까지 점차 그 영역을 확장해 가고 있다[ 13].
Figure 1.
Intact interatrial septum. LA, left atrium; RA, right atrium; RVOT, right ventricular outflow tract; AV, aortic valve. 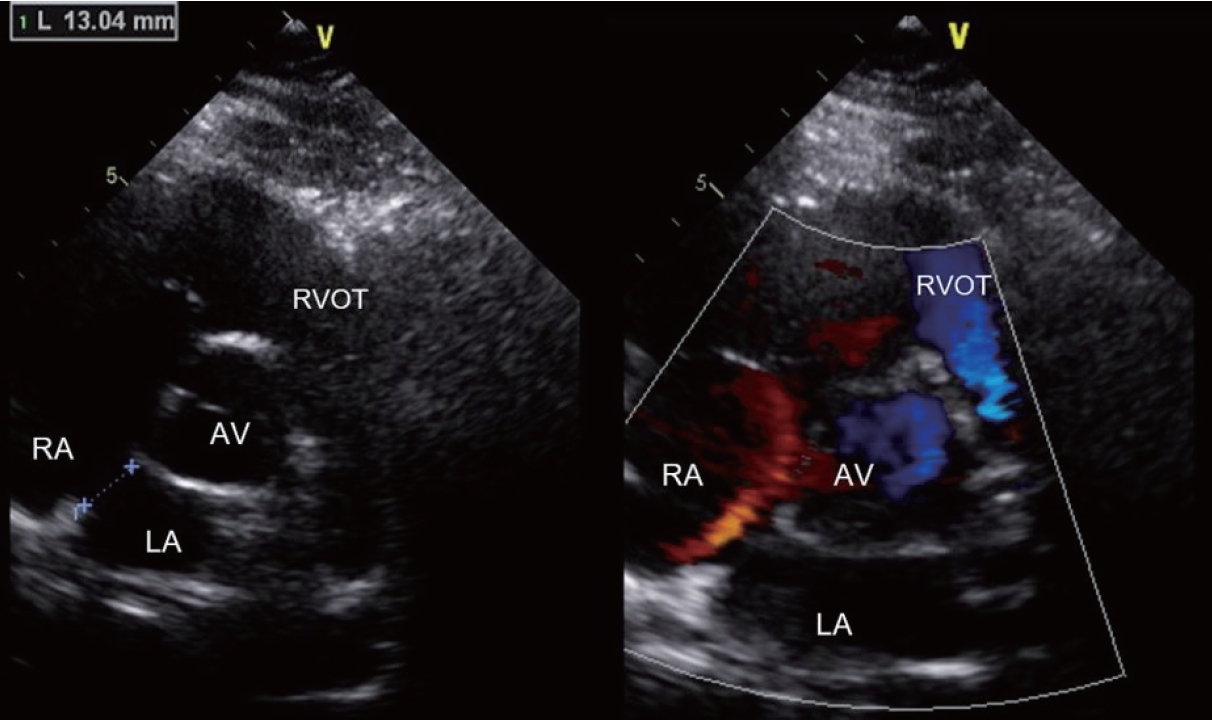
Figure 2.
Secundum versus primum atrial septal defect (ASD). (A) Transesophageal echo images (with or without color Doppler) reveal a secundum ASD with left-to-right shunt flow (arrow). (B) An apical 4-chamber image of the transthoracic echo (pediatric orientation) in the upper panel demonstrates the presence of a large primum ASD (arrow, d = 24 mm) and distinctly separate right and left atrioventricular valve orifices in diastolic phase. A parasternal short axis view in the lower panel reveals the cleft mitral valve and mitral valve regurgitation (asterisk) in systolic phase. LA, left atrium; RA, right atrium; LV, left ventricle; RV, right ventricle; MV, mitral valve. 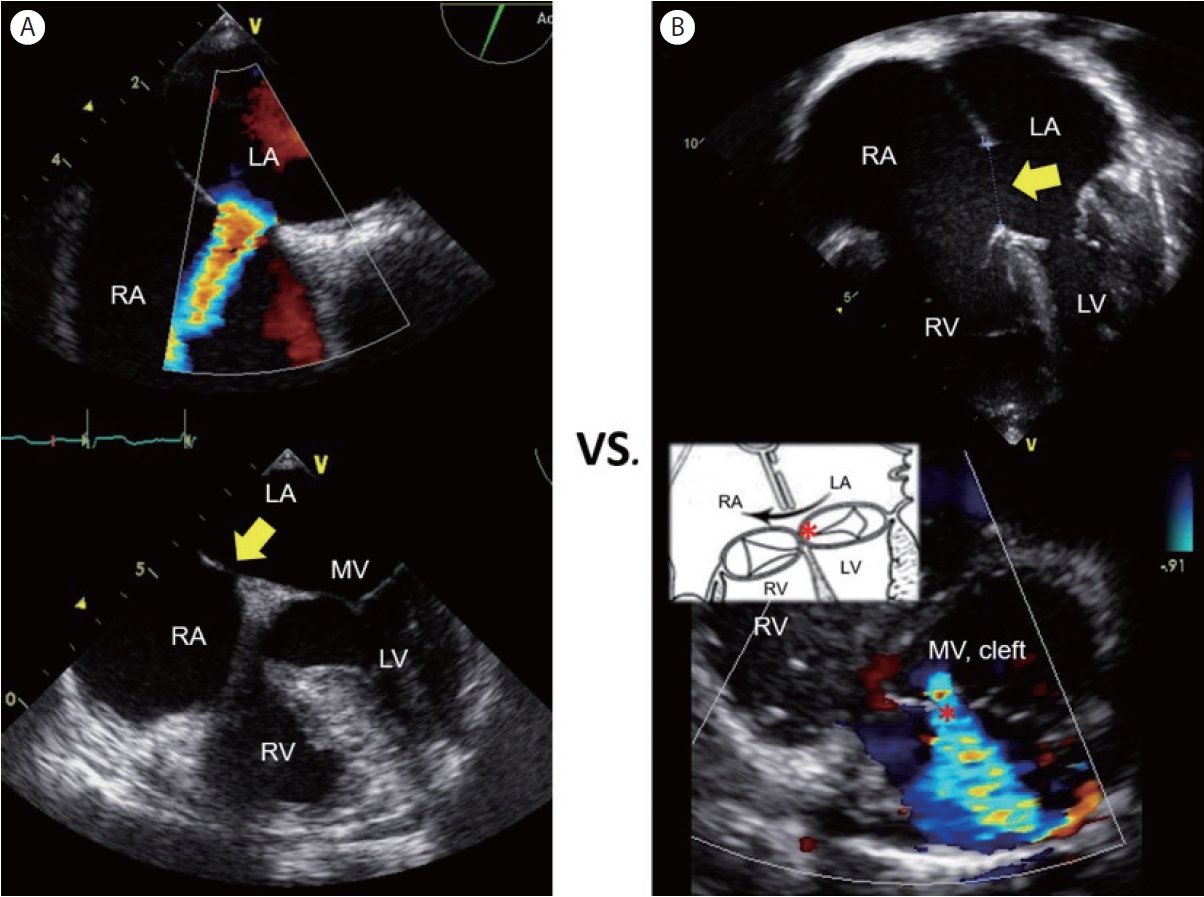
Figure 3.
Malalignment ventricular septal defect (VSD) with Eisenmenger syndrome. (A) A 4-chamber plane of the computed tomography measures the perimembranous VSD (black asterisk) size of 12.7 mm. (B, C) 2D echo images of parasternal short axis and apical 5-chamber views show a large perimembranous VSD (yellow asterisks) (d = 26 mm) with anterior malalignment of the outlet septum (over-riding aorta) without a significant right ventricular outflow tract (RVOT) obstruction. (D) Right-to-left shunt flows, (E) tricuspid regurgitation: maximum velocity of 5.3 m/s, pressure gradient of 110 mmHg, and estimated right ventricular systolic pressure of 125 mmHg, (F) pulmonic regurgitation: end-diastolic velocity of 3.3 m/s, pressure gradient of 45 mmHg. LA, left ventricle, RA, right atrium; LV, left ventricle; RV, right ventricle; AV, aortic valve; MPA, main pulmonary artery; RPA, right pulmonary artery. 
Figure 4.
Pulmonary regurgitation versus subarterial ventricular septal defect (VSD). (A) A color Doppler image of parasternal short-axis transthoracic echo shows a color jet (arrow) in the diastolic phase with a typical CW Doppler recording of the pulmonic regurgitation. (B) A subarterial VSD shunt flow (arrow) in the systolic phase. (C) The left-to-right shunt flow (arrow) peak velocity is well appreciated in the parasternal long axis image. LA, left atrium; AV, aortic valve; RVOT, right ventricular outflow tract; PV, pulmonic valve; MPA, main pulmonary artery; TV, tricuspid valve; RV, right ventricle; LV, left ventricle. 
Figure 5.
Severe pulmonic regurgitation. (A) A color Doppler image of parasternal short-axis scan reveals a laminar flow filling the right ventricular outflow tract (RVOT) in diastole. Status post perimembranous VSD patch closure (asterisk). (B) CW Doppler recording of pulmonic flow. The density of retrograde flow across the pulmonic valve (above the baseline) is equal to the density of antegrade flow in systole. The end-diastolic velocity of the pulmonic regurgitation approaches zero, indicating equalization of diastolic pressure in the pulmonary artery and right ventricle. AV, aortic valve; PV, pulmonic valve; MPA, main pulmonary artery; RPA, right pulmonary artery. 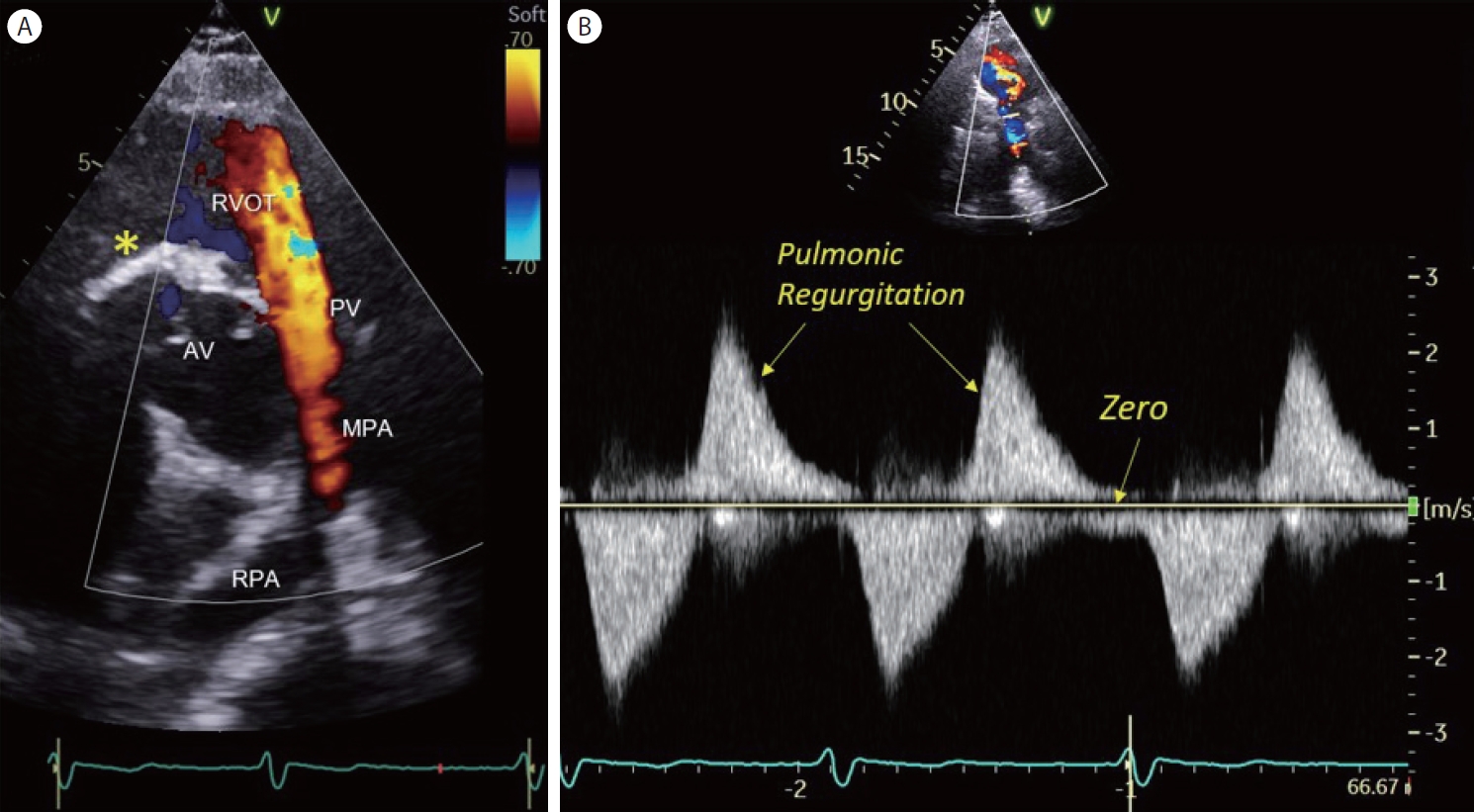
Figure 6.
Congenitally corrected transposition of the great arteries (TGA). (A) Chest X-ray showing dextrocardia. (B) Computed tomographic planes (transverse and coronal) showing corrected TGA. (C) An apical 4-chamber view of transthoracic echocardiography in the systolic phase reveals a morphologic right ventricle (mRV) in the left side (as a systemic ventricle) with an Ebstein anomaly of tricuspid valve and tricuspid regurgitation (asterisk). (D) CW Doppler recording of the tricuspid regurgitation (asterisk) jets. mLV, morphologic left ventricle; mRV, morphologic right ventricle; RA, right atrium; LA, left atrium; IVC, inferior vena cava. 
Table 1.
Structural classification of congenital heart disease
|
I. Normal sequence |
|
I-1 Shunt predominant |
• Atrial septal defect |
|
• Ventricular septal defect |
|
• AV septal defect/ Endocardial cushion defect |
|
• Patent ductus arteriosus |
|
I-2 Obstruction predominant |
• AV connection (tricuspid atresia) |
|
• VA connection (pulmonary atresia, aortic stenosis) |
|
• Great arteries (coarctation of the aorta, aortic atresia) |
|
• Venous flow (total anomalous pulmonary venous return) |
|
I-3 Anomalous valve position |
• Ebstein’s anomaly |
|
II. Abnormal sequence
|
|
II-1 Atria-ventricles |
• Double-inlet left or right ventricles |
|
• AV discordance (congenitally corrected TGA; L-TGA) |
|
II-2 Ventricle-great arteries |
• Double-outlet right and left ventricles |
|
• Tetralogy of Fallot |
|
• Truncus arteriosus |
|
• VA discordance (complete TGA; D-TGA) |
REFERENCES
1. Stout KK, Daniels CJ, Aboulhosn JA, et al. 2018 AHA/ACC Guideline for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation 2019;139:e698–e800.   2. Tennant PW, Pearce MS, Bythell M, Rankin J. 20-year survival of children born with congenital anomalies: a population-based study. Lancet 2010;375:649–656.   3. Moons P, Bovijn L, Budts W, Belmans A, Gewillig M. Temporal trends in survival to adulthood among patients born with congenital heart disease from 1970 to 1992 in Belgium. Circulation 2010;122:2264–2272.   4. van der Bom T, Bouma BJ, Meijboom FJ, Zwinderman AH, Mulder BJ. The prevalence of adult congenital heart disease, results from a systematic review and evidence based calculation. Am Heart J 2012;164:568–575.   5. Misra A, Sriram C, Gupta P, Humes R. The adult with post-operative congenital heart disease: a systematic echocardiographic approach. Curr Cardiol Rep 2019;21:29.   6. Report of the British Cardiac Society Working Party. Grown-up congenital heart (GUCH) disease: current needs and provision of service for adolescents and adults with congenital heart disease in the UK. Heart 2002;88 Suppl 1:i1–i14.  8. Devlin PJ, Backer CL, Eltayeb O, Mongé MC, Hauck AL, Costello JM. Repair of partial atrioventricular septal defect: age and outcomes. Ann Thorac Surg 2016;102:170–177.   9. Lopez L, Houyel L, Colan SD, et al. Classification of ventricular septal defects for the eleventh iteration of the international classification of diseases-striving for consensus: a report from the international society for nomenclature of paediatric and congenital heart disease. Ann Thorac Surg 2018;106:1578–1589.   10. Fukuda T, Suzuki T, Ito T. Clinical and morphologic features of perimembranous ventricular septal defect with overriding of the aorta--the so-called Eisenmenger ventricular septal defect. A study making comparisons with tetralogy of Fallot and perimembranous ventricular defect without aortic overriding. Cardiol Young 2000;10:343–352.   11. Hornung TS, Calder L. Congenitally corrected transposition of the great arteries. Heart 2010;96:1154–1161.   13. Jone PN, Haak A, Petri N, et al. Echocardiography-fluoroscopy fusion imaging for guidance of congenital and structural heart disease interventions. JACC Cardiovasc Imaging 2019;12(7 Pt 1):1279–1282.  
|
|

















