AbstractChronic liver disease is a worldwide problem, including in Korea, and its major consequence is an increasing deposition of fibrous tissue within the liver, leading to cirrhosis and finally hepatocellular carcinoma. The diagnosis and staging of liver fibrosis are important to prioritize for treatment and determine the prognosis with the potential for reversibility. Previously, the only method for diagnosing and staging of fibrosis was a liver biopsy. However, due to the limitations of liver biopsy, the recent development of ultrasound elastography (USE) techniques allows a non-invasive method of diagnosis and staging for liver fibrosis. USE enables non-invasive measurement of tissue mechanical properties through observation of shear-wave propagation in the tissue of interest. Transient elastography (TE) is a non-imaging elastographic technique that is the most popular and extensively validated method, while point shear wave elastography (p-SWE) and two-dimensional shear wave elastography (2D-SWE) combine imaging with elastography. The evidence suggests that p-SWE is as accurate as but more reliable than TE, while 2D-SWE is more accurate than TE. The author reviews the background of chronic liver disease, the types of USE, methods of examination, and interpretation of the results.
서 론만성 간 질환은 한국을 포함하여 전 세계적으로 유병률과 치사율의 주된 원인이며, 만성 B형 및 C형 간염, 알코올성 및 비알코올성 지방간과 지방간염 등이 가장 흔한 질환이다. 2019년 통계청 자료에 의하면 우리나라에서 간 질환으로 인한 한 해 사망자 수는 6,496명으로 사망 순위 8위이고, 간암으로 인한 사망자 수는 10,586명으로 이 수를 합하면 17,082명이다. 이는 암, 심장 질환, 폐렴, 뇌혈관 질환에 이어 다섯 번째로 많은 사망 원인이다[1-3].
다양한 원인의 간 손상으로 발생하는 만성 간 질환에서 공통적으로 나타나는 간 섬유화(hepatic fibrosis)는 간경변증과 간암으로 진행될 수가 있다(Fig. 1). 간 섬유화가 임상적으로 중요한 이유는 문맥 고혈압 및 만성 간 질환의 합병증 발생과 연관이 있어 환자의 예후와 밀접한 관련이 있고, 기저 간 질환을 치료하면 초기 단계의 섬유화가 호전될 수 있기 때문이다. 따라서 만성 간 질환 환자에서 조기에 간 섬유화를 진단하고 그 진행 정도를 추적 관찰하는 것이 중요하다[2-6].
현재까지 간 섬유화 진단의 절대적 기준(gold standard)인 조직 생검은 침습적이어서 통증이나 출혈 등 합병증 비율이 3%이나 아주 적은 빈도이지만 치사율(0.14-0.5%)때문에 여러 번 시행하기 어렵다. 또, 채취되는 조직의 양이 간의 1/50,000인 소량이어서 표본추출 오류(sampling error)가 있으며, 병리학자 간의 주관적 평가에 따른 결과의 가변성이 있을 수 있어 비침습적으로 간 섬유화를 평가할 수 있는 신뢰도 높은 검사의 필요성이 증대되었다. 이에 따라 대두된 간 탄성영상술(elastography)은 섬유화의 평가뿐 아니라 만성 간 질환 환자의 치료 결과를 예측하는 검사로 활발히 연구되고 있다[2-6].
초음파 탄성영상술기본 원리 및 방법탄성영상술의 공통된 원리는 조직에 압력(compression)을 가해 이로 인해 발생된 조직의 변형(deformation, strain)을 측정하는 것이다. 초음파 탄성영상술은 조직에 가해지는 압력의 특성에 따라 크게 조직의 변형률을 측정하는 변형 탄성영상술(strain elastography)과 초음파 탐촉자(transducer)에서 내보낸 음향 방사력 임펄스(acoustic radiation force impulse, ARFI)에 의하여 조직 내에서 발생된 전단파(shear wave)의 속도를 측정하여 조직의 탄성도를 파악하는 전단파 탄성영상술(shear wave elastography, SWE)로 나누어진다. 변형 탄성영상술은 외부에서 조직 표면에 균일한 압력(uniform compression)을 가해 조직의 상대적인 변형의 차이, 즉 상대적인 변형률(strain ratio)을 측정하는 방법이고 주로 표면에 있는 장기, 즉 유방이나 갑상선 질환에 이용된다(Fig. 3) [6,8].
간은 늑골에 싸여 있어 초음파 탐촉자로 압력을 가해 간의 변형을 일으키기 어려우므로 심장 박동과 같은 내부 장기 움직임에 의한 압력으로 유발된 간 조직의 변형 정도를 영상화한 유사 변형 탄성영상술(quasi-strain elastography)인 실시간 조직 탄성영상술(real-time tissue elastography)이 있으나 이용 빈도는 낮다. 주로 사용되는 전단파 탄성영상술은 순간진동(transient vibration)이나 음향 방사력을 이용하는 임펄스 압력(impulse compression)을 가해 간 조직을 변형시켜 발생한 전단파의 진행 속도를 측정해 탄성 계수(Young’s modulus) 값을 제시하는 정량적 기법이다(Fig. 4). 이 기법을 세분하면 외부 진동을 이용하는 순간 탄성영상술(transient elastography, TE)과 음향 방사력 임펄스 탄성 영상술인 점 전단파 탄성영상술(point shear wave elastography, p-SWE)과 이차원 전단파 탄성영상술(two-dimensional shear wave elastography, 2D-SWE)이 있다(Figs. 5-7) [6,9].
순간 탄성영상술(TE)순간 탄성영상술은 간의 탄성을 측정하기 위해 만들어진 일차원적 탄성영상술로 기계적 진동자(mechanical vibrator)를 이용해 작은 진폭(amplitude)과 낮은 주파수(frequency) (진폭: 2 mm, 주파수: 50 Hz)의 진동파를 피부를 통해 간에 가해 전단파를 발생시킨 후 일정 지점에서 진동자와 붙어있는 중심 주파수 3.5 MHz의 단채널(single channel) M모드 탐촉자를 이용해 전단파를 탐지하고 그 진행 속도를 측정하는 방법이다(Fig. 5). 측정된 전단파의 진행 속도는 후크의 법칙(Hook’s law)에 기초한 탄성 계수(Young’s modulus) 공식(E = 3ρc2; ρ = tissue density; liver, 1,000 kg/m3; c = shear wave velocity [m/s])에 따라 기계에서 자동적으로 간 조직의 탄성도로 변경되어 킬로파스칼(kilopascal, kPa) 단위의 탄성 계수 값으로 표현된다(2.5-75 kPa). 조직의 탄성도(E)는 전단파 진행 속도(c)의 제곱과 비례하므로 단단한 조직일수록 진행 속도는 빨라진다[6,9]. 최종 결과는 10회 반복 측정 후 중앙값을 선택한다.
점 전단파 탄성영상술(p-SWE)음향 방사력 임펄스 전단파 탄성영상술은 순간 탄성영상술과 달리 주파수 4 MHz의 B모드에 사용하는 초음파 탐촉자로, 조직 내 일정 부위에 주파수 2.67 MHz의 강도 높은 종파(longitudinal wave)를 짧은 시간 간격으로 연속적으로 집중시켜 야기된 방사력을 이용해서 초점 부위에서 가로로 전단파를 발생시키고 초음파의 여러 채널에서 내보내는 탐지 펄스(detection pulse)들이 정해진 위치에서 전단파가 지나가는 시간을 탐지해 그 진행 속도를 계산한 후 meter per second (m/s) 단위로 조직의 경직도를 제시하는 방법이다(0.5-4.4 m/s). 종파는 조직 내에서 1,540 m/s의 속도로 진행하지만 집속된 종파에 의해 발생되는 횡파(transverse wave)인 전단파의 속도는 1-10 m/s로 느리게 움직이므로 탐지 펄스에 의해 측정할 수 있다[6,9]. 폭이 6 mm이고 길이가 1 cm인 관심 구역(region of interest) 내 폭이 4 mm이고 길이가 5 mm인 국소 부위를 대상으로 전단파 속도를 측정하므로 점 전단파 탄성영상술이라 불리며 피부에서 8 cm 깊이까지 측정이 가능하다(Fig. 6). 결과는 10회 반복 측정 후 중앙값을 선택한다.
이차원 전단파 탄성영상술(2D-SWE)2005년도에 처음 소개된 슈퍼소닉회사 제품 출시 이후에 거의 모든 초음파 제조 회사들이 생산한 전단파 영상은 실시간 탄성영상을 제공한다. 이차원 전단파 영상은 음향 방사력 임펄스 전단파 탄성영상술로서 B모드 초음파 탐촉자를 사용해 집속파를 만든다. 그러나 한곳에 초음파를 집중시켜 한 개의 주파수에서 전단파를 발생시키는 점 전단파 탄성영상술과는 달리, 초음파의 종파 진행 방향으로 5개의 초점에 음파를 짧은 시간 간격으로 연속적으로 집중시켜 원뿔 모양(cone shape)으로 증폭된 높은 주파수 범위(60-600 Hz)의 전단파를 발생시킨 후 초당 20,000프레임까지 영상을 얻을 수 있는 평면파(plane wave)를 이용한 초고속 영상(ultrafast imaging)으로 전단파의 진행을 실시간으로 포착해 탄성도를 색조로 표현한(파란색: 경직도가 낮은 연한 조직, 빨간색: 경직도가 높은 단단한 조직) 이차원적 탄성영상을 B모드 초음파 영상 위에 나타낸다(Fig. 7). 이외에 전단파의 전파되는 파형을 나타내는 propagation map과 측정한 영상의 신뢰도를 나타내는 confidence map도 있다(Fig. 8). 이차원 전단파 영상은 피부에서 12 cm 깊이까지 최대 9 × 4 cm 넓이의 Shear Wave ElastographyTM (SWETM) box에 대한 탄성영상을 얻을 수 있고 여기에 한 개 이상의 크기를 조절할 수 있는 원형 Q-boxTM (3-700 mm2)를 두어 탄성을 측정할 수 있다. 측정 결과는 탄성 계수와 전단파의 진행 속도로 나타낼 수 있다[6,9-13]. 결과는 5회 반복 측정 후 중앙값을 선택한다.
검사 시 유의 사항정확한 검사를 하기 위해서는 검사 결과의 교란인자(confounder)를 제거하여야 한다. 교란인자에는 기술적 인자와 생물학적 인자가 있다(Table 1). 기술적 교란인자를 제거하기 위해서는 검사시행 방법 지침에 따라서 정확하게 하여야 한다(Table 2).
순간 탄성영상술은 기계적 진동자를 이용한 우측 늑간을 통한 간 검사이다. 음향 방사력 임펄스 전단파 탄성영상술은 늑골하스캔을 통한 측정과 간좌엽 측정이 가능하나 심장이나 대동맥의 박동, 호흡, 검사자에 의한 압박이 측정에 영항을 줄 수 있고 늑간 스캔(intercostal scan)으로 간우엽을 측정할 때와 비교해 검사의 성공률과 재현성, 간 섬유화의 진단 능력 면에서 논란이 있어 늑간 스캔으로 우엽을 측정할 것을 권고하고 있다. 따라서 검사 시 환자가 천장을 보고 바르게 누운 자세로 오른팔을 최대한 머리 위로 올린 상태에서 늑간을 통한 B모드 초음파 영상을 보고 혈관과 담관이 없는 간우엽에 관심 구역을 위치시킨 후 환자가 휴식, 자연 호흡(neutral breathing) 상태에서 잠시 호흡을 멈추도록 해 측정한다(Fig. 9). 간 피막 아래 1 cm 미만의 깊이에서 측정할 경우 반향 허상(reverberation artifact)에 의하여 재현성과 간 섬유화의 진단 능력이 떨어지므로 피해야 하며, 1.5-2 cm 깊이가 적당하다(Fig. 10). 탐촉자로부터의 거리는 4-4.5 cm가 적절하다. 음식물을 섭취한 후에는 간으로 가는 혈류량이 증가해 탄성도가 높아져서 전단파의 속도가 의미 있게 빨라지므로 최소 4시간 금식한 상태에서 검사를 시행해야 한다[5,13-15].
최종 결과는 점 전단파 탄성영상술의 경우 10회, 이차원 전단파 탄성영상술의 경우 5회 반복 측정 후 기계가 자동으로 나타내 준다. 한 연구에서 측정값들이 순간 탄성영상술에서 도입한 검사의 신뢰도 평가 지표를 만족하지 못했을 때 조직학적 간 섬유화와 의미 있는 연관성이 없는 것으로 보고되어 음향 방사력 임펄스 탄성영상술에서도 60% 이상에서 측정한 값들의 표준편차가 중앙값의 30% 미만이 되도록 검사를 시행하는 것이 바람직하다[5,15].
탄성영상술로 얻은 값의 의미를 정확히 해석하기 위해서는 섬유화 이외의 간의 탄성에 영향을 미치는 생물학적 교란인자들을 이해해야 한다(Table 1). 만성 바이러스성 간염에서 간염 바이러스가 재활성되거나 급성 바이러스성 간염을 비롯한 급성 간 손상으로 알라닌 아미노전이효소(alanine aminotransferase) 수치가 증가하였을 때(> 100 IU/L), 간외 담즙정체(extrahepatic cholestasis), 우심부전증, 아밀로이드증(amyloidosis)이 있을 때에는 순간 탄성영상술의 측정 수치가 증가할 수 있다고 보고되어 있다[10,13-15]. 그 이유는 간염에 나타나는 염증세포의 침윤과 간세포의 팽윤, 조직 부종이 간의 탄성을 증가시키기 때문이다. 담즙정체에서는 간 내 정수압 증가 및 이로 인한 이차적 염증과 섬유화가, 우심부전증에서는 간 내 혈관의 정수압 증가가 간의 탄성을 증가시킨다. 따라서 이러한 질병을 동반하고 있는 만성 간 질환 환자에서는 탄성영상술로 간 섬유화를 평가해서는 안된다. 결론적으로, 탄성영상술로 간 섬유화를 진단할 때에는 반드시 환자의 병력과 기저 간 질환, 생화학 검사 결과를 살펴보고 간의 탄성에 영향을 미칠 수 있는 요인들이 있는지 확인하여야 한다(Table 1) [11,16].
진단 능력순간 탄성영상술은 2003년에 도입된 최초의 간 탄성영상술로 그동안 여러 메타분석(meta-analysis)을 포함해 가장 많은 임상 연구들이 진행되어 왔으며, 만성 바이러스성 간염을 비롯한 다양한 만성 간염에서 간 섬유화 정도를 평가하는 데 간단하면서도 효과적인 방법으로 인정받고 있다[2,4,9,12]. 가장 많은 50개 논문에 대한 메타분석에 따르면, Metavir 기준의 간 섬유화 병기로 F2 이상의 중등도 섬유화(significant fibrosis)와 F3 이상의 중증 섬유화(severe fibrosis), F4에 해당하는 간경변(liver cirrhosis)을 진단하는 데 있어 순간 탄성영상술의 평균 area under the receiver operating characteristic curve (AUC)는 각각 0.73-0.91, 0.83-0.95, 0.87-0.97로 보고되었다[3]. 또한 모든 메타분석에서 순간 탄성영상술은 간경변의 진단에 우수한 민감도와 특이도를 보인다고 보고되었다(Table 3) [3]. 기존의 많은 임상 연구들에 기초해 최근에 발표된 유럽초음파학회(European Federation of Societies for Ultrasound in Medicine and Biology, EFSUMB) 가이드라인에 따르면, 순간 탄성영상술은 만성 C형 간염과 B형 간염에서 간 섬유화 정도를 평가할 수 있고, 특히 간 섬유화 병기 중 F2 이상의 중등도 섬유화와 F4에 해당하는 간경변을 진단할 수 있다[15]. 또한 비알콜성 지방간질환(nonalcoholic fatty liver disease, NAFLD) 알코올성 간질환(alcoholic liver disease), 인간 면역 결핍 바이러스(human immunodeficiency virus, HIV)-C형 간염 바이러스 동시 감염, 간이식 후 재발한 C형 간염에서 간 섬유화 정도 평가에 유용하다고 보고하였다. 그러나 동일한 간 섬유화 단계에서도 구분값(cut-off value)의 범위가 비교적 넓어 연속된 간 섬유화 단계에서는 서로 겹치는 값들이 있어 연속된 간 섬유화 단계를 구별하는 데 있어서는 제한이 있고 연구자와 섬유화를 일으키는 기저 간 질환에 따라 구분값이 다르게 보고되어 아직까지 각각의 간 섬유화 단계를 진단할 수 있는 최적의 구분값은 결정되어 있지 않다[2,3,5]. 그러므로 향후 기저 간 질환에 따라 간 섬유화 단계를 진단할 수 있는 최적의 구분값을 제시하고 이 값을 입증하는 연구가 필요하다[2,5,13].
음향 방사력 임펄스 탄성영상술은 2009년에 도입된 이래 다양한 만성 간염에서 순간 탄성영상술과 비교한 연구들이 진행되어 왔다[2,3,10,12,13]. 이들 연구에서 음향 방사력 임펄스 탄성영상술은 만성 C형 간염, 만성 B형 간염, 비알콜성 지방간질환에서 Metavir 기준 F3 이상의 증증 섬유화와 F4에 해당하는 간경변증을 진단하는 데 있어 순간 탄성영상술과 동등하다고 나타났으며 최근의 메타분석에서는 F2 이상의 중등도 섬유화와 간경화의 진단에 동등한 민감도와 특이도, 오즈비(odds ratio)를 보인다고 보고되었다. 가장 많은 논문에 대한 최근의 메타분석에 따르면, 중등도 섬유화와 중증 섬유화, 간경변증을 진단하는 데 있어 음향 방사력 임펄스 탄성영상술의 평균 AUC는 각각 0.81-0.92, 0.88-0.95, 0.89-0.98의 성적을 보였다(Table 4) [3]. 그러나 순간 탄성영상술에 비해 비바이러스성 만성 간염에 대한 임상적 증거는 아직 충분하지 않아 유럽초음파학회 가이드라인에서는 음향 방사력 임펄스 탄성영상술이 만성 바이러스성 간염, 특히 C형 간염에서 간 섬유화의 정도를 평가할 수 있고, 비알코올성 지방간 질환과 이식간에서 간 섬유화를 평가하는 데 유망하다고 보고하였다[15]. 또한 순간 탄성영상술과 마찬가지로 동일한 간 섬유화 단계를 진단하는 구분값의 범위가 비교적 넓어 연속된 간 섬유화 단계에서는 구분값의 차이가 작거나 서로 겹치는 값들이 있어 연속된 간 섬유화 단계를 구별하는 데 있어서는 제한이 있고 연구자와 섬유화를 일으키는 기저 간 질환에 따라 구분값이 다르게 보고되고 있어 아직까지 각각의 간 섬유화 단계를 진단할 수 있는 최적의 구분값이 결정되어 있지 않다[2]. 그러므로 특히 간 섬유화의 초기 단계를 진단할 때에는 기존의 구분값을 엄격히 적용하기 보다는 임상적, 기계적 환경에 따라 구분값을 조정해 나가는 것이 바람직하며 향후 추가적인 연구가 필요하다[2,3,14].
임상 지침(clinical practice guideline)초음파 탄성영상술에 대한 임상 지침과 권고 사항은 2013년 유럽초음파학회에서 학회 공식학술지인 Ultraschall in Medicine에 최초로 발표하였다[16]. 그 후에 초음파 탄성영상술에 대한 각국의 관심과 연구의 진전에 따라 세계초음파의학회(World Federation of Ultrasound in Medicine and Biology, WFUMB)에서도 2015년에 새로운 임상 지침과 권고안을 공식학술지인 Ultrasound in Medicine and Biology에 발표하였다[4].
최근에 초음파 탄성영상술의 기법은 초음파 연구의 가장 뜨거운 주제로 등장하여 여러 가지 방법이 개발되고 연구되고 있으며 점차 임상적인 효용성이 증가되고 있음이 여러 메타분석을 통한 연구로 밝혀지고 있다. 이에 따라 유럽초음파학회는 2017년 간의 초음파 탄성영상술에 대한 개정판을 Ultraschall in Medicine에 발표하였고[17], 세계초음파의학회도 2018년도에 개정판을 Ultrasound in Medicine and Biology에 발표하였다[14]. 가장 최근인 2020년도에는 미국의 초음파영상의학회(Society of Radiologists in Ultrasound)에서 간 탄성영상술에 대한 합의 성명서(consensus statement)를 Radiology에 발표하였다[15].
결 론만성 간 질환은 한국을 포함하여 전 세계적으로 비교적 높은 유병률과 치사율을 보이는데, 가장 흔한 질환으로는 만성 B형 및 C형 간염과 알코올성 및 비알코올성 지방간과 지방 간염 등이다.
간 섬유화는 만성 간 질환을 포함한 다양한 간 손상에 의하여 발생하며 만성 간 질환이 진행될수록 섬유화에 따른 간의 경직도는 증가한다. 그러므로 적절한 치료를 하지 않으면 간경변과 최종적으로 간암으로 진행된다. 간 섬유화를 진단하는 방법은 과거에는 조직검사가 최선이었으나 침습적이고, 검출물 크기의 제한이 있으며, 판독자의 주관성 등의 단점이 있다. 따라서 간 섬유화를 비침습적으로 진단하고 병기를 결정하는 것은 치료의 적정성과 이에 따른 질환의 가변성을 예측하며 예후를 평가하는 데 매우 중요하다.
초음파 탄성영상술은 과거 20년 동안에 괄목할 만한 발전을 이루었으며 간 질환에는 순간 탄성영상술, 점 전단파 탄성영상술과 이차원 전단파 탄성영상술이 이용되고 있다. 간 섬유화의 측정치는 측정하는 방법이나 사람에 따라서 달라진다. 따라서 신뢰도를 높이려면 정확히 재현성 있게 측정하여야 하며 공복, 호흡 조절, 측정 자세, 측정 위치 등을 일정하게 하여야 하고 인공물, 혈관 등을 피하는 등 측정치의 기술적 교란요인을 배제하여야 한다. 또한 간의 경직도는 조직 내의 섬유화를 포함한 기질의 침착과 수압이나 삼투압 등의 압력의 변화에 의하여 결정된다. 따라서 생물학적 교란요인이 있는 간염을 포함한 염증성 질환이나 울혈성 질환 등에는 간 섬유화의 측정치가 상승하므로 임상 응용에 제한점이 있다. 그러나 현 시점에서 순간 탄성영상술은 임상적으로 가장 많이 사용되었고 많은 연구에 의한 증거에 의하여 가치 있는 검사 방법으로 알려져 있고, 점 전단파 탄성영상술은 진단 능력이 순간 탄성영상술과 같거나 검사의 신뢰도는 더 우월하며, 이차원 전단파 탄성영상술은 순간 탄성영상술보다 진단 능력이 우월하다고 알려져 있다.
결론적으로 간 초음파 탄성영상술은 간 섬유화를 비침습적으로 측정하는 객관적이며 정확한 방법으로 인정받고 있으며, 특히 섬유화 병기 F2 이상에서는 정확도가 높은 방법으로 여러 메타분석 연구에서 객관적 증거를 제시하고 있다.
Figure 1.Etiology and consequences of hepatic fibrosis. NASH, nonalcoholic steatohepatitis. Courtesy of Dr. Koung Bun Lee. 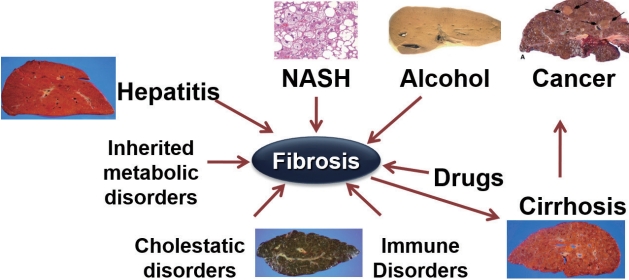
Figure 3.Fundamental physics and technology of ultrasound elastography (USE). Modified from Shiina et al. [6]. E, elastography; SW, shear wave; 1D, one-dimensional; 2D, two-dimensional. 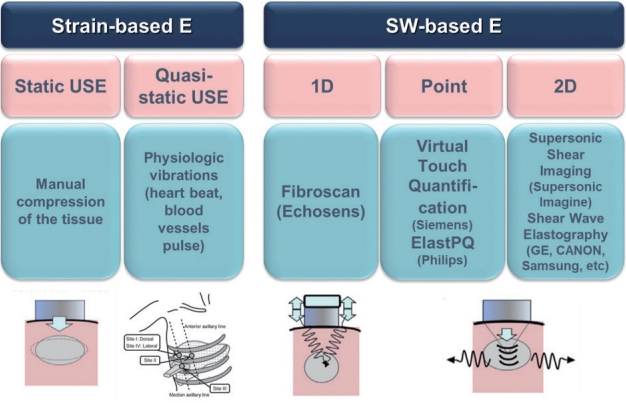
Figure 8.Various maps of 2-dimensional shear wave elastography (2D-SWE). (A) Visual maps. (B) Propagation map. (C) Confidence map. 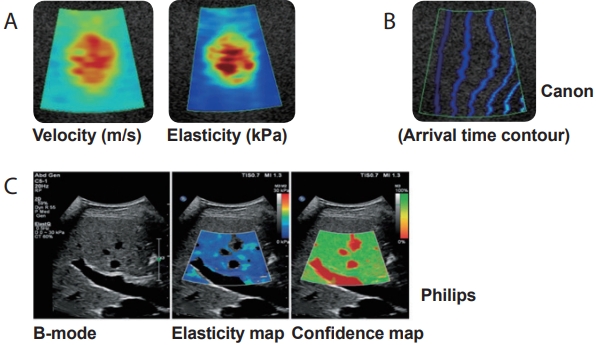
Table 1.Confounders of stiffness in the measurement of ultrasound elastography
Table 2.Measurement technique to avoid technical confounders for high reproducibility of SWE Table 3.Diagnostic performance of transient elastography
Modified from Kennedy et al. [3]. Successful measurements exclude failures and unreliable results. AUC, area under the receiver operating characteristic curve; HCV, hepatitis C virus; HBV, hepatitis B virus; NAFLD, nonalcoholic fatty liver disease. Table 4.Diagnostic performance of p-SWE and 2D-SWE
Modified from Kennedy et al. [3]. p-SWE, point shear wave elastography; SWE, shear wave elastography; 2D, two-dimensional; AUC, area under the receiver operating characteristic curve; HCV, hepatitis C virus; HBV, hepatitis B virus; NAFLD, nonalcoholic fatty liver disease. REFERENCES1. Yang H. Disease burden by liver disease. In: Korean Association for the Study of the Liver, ed. White Paper on Liver Diseases in Korea. Seoul: YDNP, 2021.
3. Kennedy P, Wagner M, Castéra L, et al. Quantitative elastography methods in liver disease: current evidence and future directions. Radiology 2018;286:738–763.
4. Ferraioli G, Filice C, Castera L, et al. WFUMB guidelines and recommendations for clinical use of ultrasound elastography: part 3: liver. Ultrasound Med Biol 2015;41:1161–1179.
5. Barr RG, Ferraioli G, Palmeri ML, et al. Elastography assessment of liver fibrosis: society of radiologists in ultrasound consensus conference statement. Radiology 2015;276:845–861.
6. Shiina T, Nightingale KR, Palmeri ML, et al. WFUMB guidelines and recommendations for clinical use of ultrasound elastography: part 1: basic principles and terminology. Ultrasound Med Biol 2015;41:1126–1147.
7. Mueller S, Sandrin L. Liver stiffness: a novel parameter for the diagnosis of liver disease. Hepat Med 2010;2:49–67.
8. Barr RG, Nakashima K, Amy D, et al. WFUMB guidelines and recommendations for clinical use of ultrasound elastography: part 2: breast. Ultrasound Med Biol 2015;41:1148–1160.
9. Tang A, Cloutier G, Szeverenyi NM, Sirlin CB. Ultrasound elastography and MR elastography for assessing liver fibrosis: part 1, principles and techniques. AJR Am J Roentgenol 2015;205:22–32.
10. Tang A, Cloutier G, Szeverenyi NM, Sirlin CB. Ultrasound elastography and MR elastography for assessing liver fibrosis: part 2, diagnostic performance, confounders, and future directions. AJR Am J Roentgenol 2015;205:33–40.
11. Woo H, Lee JY, Yoon JH, Kim W, Cho B, Choi BI. Comparison of the reliability of acoustic radiation force impulse imaging and supersonic shear imaging in measurement of liver stiffness. Radiology 2015;277:881–886.
12. Lee ES, Lee JB, Park HR, et al. Shear wave liver elastography with a propagation map: diagnostic performance and inter-observer correlation for hepatic fibrosis in chronic hepatitis. Ultrasound Med Biol 2017;43:1355–1363.
13. Sigrist RMS, Liau J, Kaffas AE, Chammas MC, Willmann JK. Ultrasound elastography: review of techniques and clinical applications. Theranostics 2017;7:1303–1329.
14. Ferraioli G, Wong VW, Castera L, et al. Liver ultrasound elastography: an update to the world federation for ultrasound in medicine and biology guidelines and recommendations. Ultrasound Med Biol 2018;44:2419–2440.
15. Barr RG, Wilson SR, Rubens D, Garcia-Tsao G, Ferraioli G. Update to the society of radiologists in ultrasound liver elastography consensus statement. Radiology 2020;296:263–274.
16. Bamber J, Cosgrove D, Dietrich CF, et al. EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography. Part 1: basic principles and technology. Ultraschall Med 2013;34:169–184.
17. Dietrich CF, Bamber J, Berzigotti A, et al. EFSUMB guidelines and recommendations on the clinical use of liver ultrasound elastography, update 2017 (short version). Ultraschall Med 2017;38:377–394.
18. Kim JE, Choi BI. Ultrasound elastography of the liver. In: Choi BI, ed, ed. Ultrasound diagnosis of the abdomen. 3rd ed. Seoul: Ilchokak, 2015:595–608.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||