췌장낭성 병변의 감별진단에서 초음파 내시경의 활용
Abstract
Pancreatic cystic lesions (PCLs) are being identified increasingly because of recent advancements in abdominal imaging technologies, presenting a number of challenges in clinical practice. Although most PCLs are benign, some carry a significant risk of malignant degeneration. Accurate diagnosis of PCLs is important for proper management and follow-up. Endoscopic ultrasound (EUS) is useful for the characterization of PCLs with high sensitivity and accuracy. Additional information can be obtained using EUS for indeterminate lesions on computed tomography or magnetic resonance imaging. In this review, we introduce the relevant EUS findings for the diagnosis of relatively common PCLs.
Keywords: Pancreatic cyst; Pancreatic neoplasm; Endosonography
중심 단어: 췌장낭종; 췌장종양; 내시경 초음파
서 론
최근 건강검진의 보편화 및 영상학적 검사의 발전으로 췌장낭성 병변(pancreatic cystic lesion)의 진단이 증가하고 있다. 국내에서 수행된 대규모 연구에 의하면 증상이 없는 췌장낭성 질환의 유병률은 2.1%로 보고되었다[ 1, 2]. 췌장낭성 병변은 단순 낭종(simple cyst), 가성낭종(pseudocyst)과 같은 비종양성 췌장낭종과 종양성 췌장낭종(neoplastic pancreatic cyst) 그리고 고형종양의 낭성 변화로 구분할 수 있다. 종양성 췌장낭종에는 장액성낭성종양(serous cystic neoplasm, SCN), 고형가성유두상종양(solid pseudopapillary neoplasm, SPN)과 같은 점액을 분비하지 않는 병변과, 췌관내유두상점액종양(intraductal papillary mucinous neoplasm, IPMN), 점액성낭성종양(mucinous cystic neoplasm, MCN)과 같은 점액을 분비하는 병변이 포함된다. 췌장에서 낭성 병변은 임상적으로 중요한데, 종류에 따라 잠재적으로 악성 병변으로 진행할 가능성이 있기 때문이다[ 3]. 단순낭종은 낭종의 벽이 정상적인 상피세포로 구성되어 있는 양성 병변으로 매우 드물고 특별한 치료가 필요하지 않다. 고형종양의 낭성 변화 역시 드물고 일반적인 상황에서는 고려되지 않는다. 따라서 췌장의 낭성 병변에서 우선 가성낭종과 종양성 췌장낭종에 대한 감별진단이 필요하며, 종양성 췌장낭종으로 진단되면 악성도 유무의 평가가 중요해진다. 췌장은 후복막강 장기로 전방에는 소화관이 위치해 있다. 이러한 해부학적 위치에서 기인한 시야의 제한으로, 복부 초음파(transabdominal ultrasonography)를 이용하여 췌장을 자세히 관찰하기는 쉽지 않다. 췌장낭성 병변의 진단에 컴퓨터 단층촬영(computed tomography, CT)과 자기공명영상(magnetic resonance imaging, MRI)이 추천되며 양성과 악성 감별의 정확도는 76-91%, 점액성과 비점액성 병변 감별의 정확도는 80% 정도의 양호한 결과를 보여주었다. 하지만 췌장의 낭성 병변에서 병명을 올바로 진단할 수 있는 정확도는 50% 정도로 낮은 수준이다[ 4- 6]. 크기가 작거나 특징적인 소견을 보이지 않아서 CT, MRI로 감별이 어려운 췌장낭성 병변의 진단에서 초음파 내시경(endoscopic ultrasound, EUS)의 역할이 중요시되고 있다. CT보다 내부 구조를 관찰하는 것이 유리하며, 벽 결절(mural nodule) 유무 및 주위조직의 침윤 등의 악성화 소견을 구분하는 데 있어 효과적이다. 조영제를 이용한 조영증강 초음파 내시경(contrast-enhanced endoscopic ultrasound, CH-EUS)은 종양의 관혈류 및 미세순환의 특징이 부각되어 양성과 악성의 감별 능력이 향상된다[ 7]. 하지만 CT, MRI와는 달리 시술자의 숙련도가 진단의 정확도에 큰 영향을 주는 단점이 존재한다[ 8]. 본고에서는 대표적인 췌장낭성 질환의 특징을 알아보고, 진단에 도움이 되는 전형적인 EUS 소견을 정리하고자 한다.
본 론
췌장의 낭성 병변에서 EUS 단독 시행 시 진단의 정확도는 40-94%로 알려져 있다[ 9- 11]. EUS로 췌장의 낭성종양을 검사할 때는 병변의 위치, 크기, 석회화 동반 유무, 주변 조직과의 관련성 등을 관찰한다. 또한 병변 내부의 격막 유무 및 두께, 벽 결절, 췌관과의 교통이 있는지도 확인한다. 이러한 소견들을 종합하여 종양의 진단 및 악성화의 가능성을 평가한다.
췌관내유두상점액종양(intraductal papillary mucinous tumor)
대표적인 췌장의 전암성 병변으로 췌장낭성종양의 40-50%를 차지한다[ 12]. 주췌관 혹은 부췌관에 유두상 성장을 하는 점액성 췌관세포가 존재하며, 여기서 다량 분비된 점액으로 췌관이 확장되어 낭종을 형성한다. 60대 이상의 고령의 남성에서 호발하며 주로 췌장 두부에서 발생한다[ 13]. 크게 주췌관형(main duct type), 분지췌관형(branch duct type) 그리고 혼합형(mixed type)으로 분류된다. 주췌관형의 EUS 소견은 미만성 혹은 분절성으로 5 mm 이상 확장된 췌관이 관찰된다( Fig. 1A). 악성 종양의 비율은 61.6%로 보고되고 있으며, 내부에 벽 결절이 동반되거나, 병변 주위에 관찰되는 림프절의 존재는 악성 변화를 시사하는 소견이다[ 14]. 만성 췌장염에서도 췌관 확장이 동반되므로 감별진단이 어려울 수 있다. 만성 췌장염에서 관찰되는 췌관 확장은 다발성 협착 및 췌관결석이 동반되며 췌장실질의 위축 등도 관찰된다. 만성 췌장염 기왕력의 부재, 내시경 시야에서 바터팽대부 입구에 점액이 흘러나오는 소견이 보이면 감별진단에 도움이 된다( Fig. 1B). 분지췌관형은 낭종의 직경이 5 mm 이상이면서 주췌관과 교통이 있는 경우로 정의하고 있다. 일반적으로 포도송이모양(grape-like)으로 여러 개의 작은 낭들이 모여 있는 형태 또는 내부 격막이 있는 낭성 병변(multiseptated cyst) 소견을 보이며 그 밖에 다형성(pleomorphic), 또는 낭종 외 낭종(cyst by cyst) 형태도 보인다( Fig. 2). 주췌관은 정상이거나 경미한 확장을 동반한다. 분지췌관형은 매우 다양한 형태를 보일 수 있어, 주췌관과의 교통이 명확히 관찰되지 않는 경우 다른 낭성종양과 감별이 어려울 수 있다. 혼합형은 주췌관형과 분지췌관형의 구분이 모호한 경우로 정의한다. 2017년 개정된 Fukuoka 가이드라인에서 고등급 이형성증(high-grade dysplasia)이나 침습적 선암(invasive carcinoma)을 포함하는 악성 병변을 예측하기 위해서 ‘worrisome features’와 ‘high-risk stigmata’라는 개념을 제시하였고, ‘high-risk stigmata’가 있으면 수술을, ‘worrisome features’가 있으면 EUS를 시행하여 그 결과에 따라 수술을 하거나 추적 관찰을 권고하였다( Table 1) [ 14]. EUS는 악성 병변의 위험인자로 지적되는 벽 결절 및 벽 비후 진단에 있어서 CT, MRI에 비하여 높은 민감도를 보인다. 또한 방사선 노출의 위험이 없어 젊은 나이에 IPMN이 발견되어 장기간 추적 검사를 해야 하는 환자에서 안전하게 사용할 수 있다.
점액성낭성종양(mucinous cystic tumor)
점액성낭성종양은 췌장에 생기는 낭종 가운데 약 10% 정도를 차지하며, 췌장 체부와 미부에 주로 발생한다[ 15, 16]. MCN은 조직학적으로 난소와 유사한 간질(ovarian-like stroma)을 병리 진단의 특징으로 하기 때문에 90% 이상이 여성에서 나타나고 주로 중년에 호발한다[ 17]. 주로 췌장실질과 경계가 명확한 단방성의 단일 종괴로 발견되며, 낭벽은 비교적 얇은 편이다( Fig. 3). 그밖에 다격벽(multiseptated), 낭종 내 낭종(cyst in cyst) 형태로도 나타난다. 각각의 낭종 크기는 보통 SCN보다는 더 크며, 낭종 안에 결절, 내부에 얇은 격막 등의 소견은 SCN과 구분되는 중요한 소견이다. 때때로 달걀껍질모양 또는 곡선모양의 석회화(curvilinear wall calcification)가 병변의 가장자리에서 관찰되어 감별진단에 도움이 된다[ 18]. 대부분 췌관의 교통은 없으며, 췌관과 연결이 있으면 IPMN을 먼저 생각해야 한다. IPMN과 마찬가지로 시간 경과와 함께 서서히 악성화가 진행될 수 있는 잠재적인 악성 병변이다. 하지만 모든 MCN이 악성 낭종으로 진행하지는 않기 때문에 감별진단이 매우 중요하다. 악성화의 가능성은 크기가 증가할수록 커진다. 병변이 4 cm 이상이거나, 벽이 두껍거나 불규칙한 경우, 격막을 동반한 경우, 내부에 조영증강 되는 고형 성분이나 벽 결절을 동반한 경우에는 악성 변화의 가능성을 시사한다[ 14, 19, 20]. 그밖에 췌관을 막고 있거나 변형시킨 경우, 주변에 고형종괴가 있는 경우에도 악성 변화의 가능성을 고려해야 한다. 이러한 악성 변화를 시사하는 소견이 없는 MCN은 장기간 경과 관찰을 하여야 한다.
장액성낭성종양(serous cystic neoplasm)
췌장 두부에서 호발하며[ 16], 40-60대의 여성에서 주로 발생한다[ 21]. 일반적으로 악성화 가능성은 낮지만, 발견 당시 4 cm 이상인 병변은 매년 2 cm의 속도로 커질 수 있으며, 크기가 커져 증상을 유발하는 경우 수술적 치료가 필요하다[ 22, 23]. 주로 소낭성(microcystic), 다방성(multolocular) 낭종으로 나타난다. 3 mm 미만의 미세낭이 모인 벌집모양(honeycomb-like)으로 관찰될 수 있으며( Fig. 4A), CH-EUS에서는 수많은 낭종의 격막들이 과조영(hyperenhancement)되는 양상으로 관찰된다[ 24]. 이 병변은 조영증강 CT에서는 마치 과혈관성의 고형종괴처럼 보이기도 한다. EUS에서 관찰되는 2 mm 이하의 작은 미세낭은 CT에서는 잘 관찰되지 않으며, SCN의 약 86%에서 관찰되는 진단적 가치가 높은 소견이다[ 25]. 과소낭성(oligocystic) 혹은 2 cm 이상의 대낭성(macrocystic) 양상을 보이면 MCN과 감별이 어렵고( Fig. 4B), 소낭(microcyst)과 대낭(macrocyst)이 혼재되어 있어 분지췌관형 IPMN처럼 보이는 경우도 존재한다( Fig. 4C). 두꺼운 일부 낭종벽, 낭종 내 벽 결절, 주췌관과의 교통 혹은 췌관의 확장 등이 관찰되면 점액성종양을 우선 고려한다[ 26]. 중심부 석회화(central calcification)는 진단에 특이적이나 SCN의 30% 정도에서만 동반된다[ 18].
고형가성유두상종양(solid pseudopapillary neoplasm)
췌장 모든 부위에서 발견되나 미부에서 약간 더 높은 비율로 발생하며 20-30대의 젊은 여성에서 호발한다[ 27, 28]. 초기에는 피막에 잘 싸여있어 주위와 경계가 좋은 고형종괴로 관찰된다( Fig. 5A). 종양이 자라면서 병변 내부가 괴사되고 출혈이 동반되면서 고형종괴와 낭성 변화 부위가 혼재하게 된다. EUS 영상에서 내부 출혈 및 괴사의 정도에 따라 고형 또는 낭종까지 다양한 양상으로 관찰될 수 있으며, 약 30%에서 낭종의 석회화를 동반한다( Fig. 5B) [ 18, 27, 28]. 심한 석회화는 EUS 검사에서 병변의 자세한 관찰을 방해하기도 한다. SPN은 15-20%에서 간, 복막, 림프절 등으로 전이를 일으킬 수 있으므로 수술적 절제가 권고된다[ 29, 30].
가성낭종(pseudocyst)
가성낭종은 급성 췌장염의 발생 3-4주 후 췌장 주위에 형성되는 잘 구획된 낭성 병변으로 정의된다. 췌장염이나 외상 등에 의해 손상된 췌관 혹은 췌장실질에서 유리된 췌장삼출액이 복강 내에 저류되어 형성된다. 주로 췌장 밖으로 돌출된 무에코의 단일낭으로 관찰되며, 상피세포가 아닌 염증세포와 섬유화 조직으로 구성된 얇은 피막으로 구성되어 있다. 감염, 찌꺼기(debris), 출혈 등이 있으면 낭종 내부에 에코가 있는 물질이 관찰되기도 한다( Fig. 6). 대략 65-70%에서 주 췌관과의 연결성이 관찰된다. 내부 격막 및 벽 결절의 부재가 다른 낭성종양과의 감별점이 될 수 있다[ 31]. 하지만 가성낭종의 내부에 고형물이 동반되거나, 병변이 오래되면 내부 격막이 보일 수 있어 감별이 어려울 수 있다. 이런 경우 급성, 만성 췌장염의 병력, 췌장 실질의 위축, 사행성 췌관, 췌장의 석회화 등 만성 췌장염의 소견을 보이는 경우 진단에 도움이 된다. 그러나 일부 췌장염의 원인이 췌장종양인 경우가 있으므로 비록 췌장염의 병력이 있어도 가성낭종이 아닐 수 있다. 그리고 췌장염의 병력 없이 가성낭종이 발생하는 경우도 있으므로 주의가 필요하다. 췌장 가성낭종은 악성화의 위험이 없는 양성종양으로 증상이 없으면 치료를 요하지 않는다[ 32].
결 론
주요 췌장낭성 병변은 가성낭종과 낭성종양으로 구분되고, 낭성종양은 다시 IPMN, MCN, SCN, SPN으로 분류된다. 잠재적 악성화 위험이 있는 병변을 감별하는 것이 중요하며, 췌장의 해부학적인 위치 때문에 경복부 초음파의 역할이 제한적이라 일반적으로 CT, MRI가 추천되며, 필요에 따라 EUS를 추가한다. 추적 검사로는 CT, MRI 그리고 EUS를 적절히 혼용하여 사용한다. 건강검진의 보편화와 영상 검사의 해상력이 향상되면서 증상 없이 우연히 발견되는 췌장낭성종양의 비율이 높아지고 있다. 그 결과 첫 진단되는 췌장낭성종양의 크기도 작아지는 경향을 보이고 있으며, 일반적인 단면 영상 검사만으로 분류하기는 점차 어려워지고 있다. CT, MRI에서 진단이 불확실한 경우, 악성 가능성에 대한 평가가 필요한 경우 EUS의 역할이 중요시되고 있다. EUS는 특징이 명확하지 않은 작은 병변, 벽 결절 및 주위 조직으로의 침윤 여부를 관찰하는 데 효과적이다. 하지만 EUS는 시술자의 숙련도가 결과에 큰 영향을 줄 수 있으며, 건강보험 급여가 인정되지 않는 고가의 검사라는 단점이 있다. 췌장낭성종양의 적절한 진단과 치료를 위하여 EUS에 대한 적극적인 질 관리 및 조속한 급여 인정이 필요할 것으로 보인다. 향후 한국인을 대상으로 한 췌장낭성종양의 전향적 대규모 연구를 기대해 본다.
Figure 1.
Endoscopic ultrasound image of main duct-intraductal papillary mucinous neoplasm. (A) Dilatation of the main pancreatic duct within the body of the pancreas. (B) Endoscopic visualization of mucin extruding from a patulous papilla. 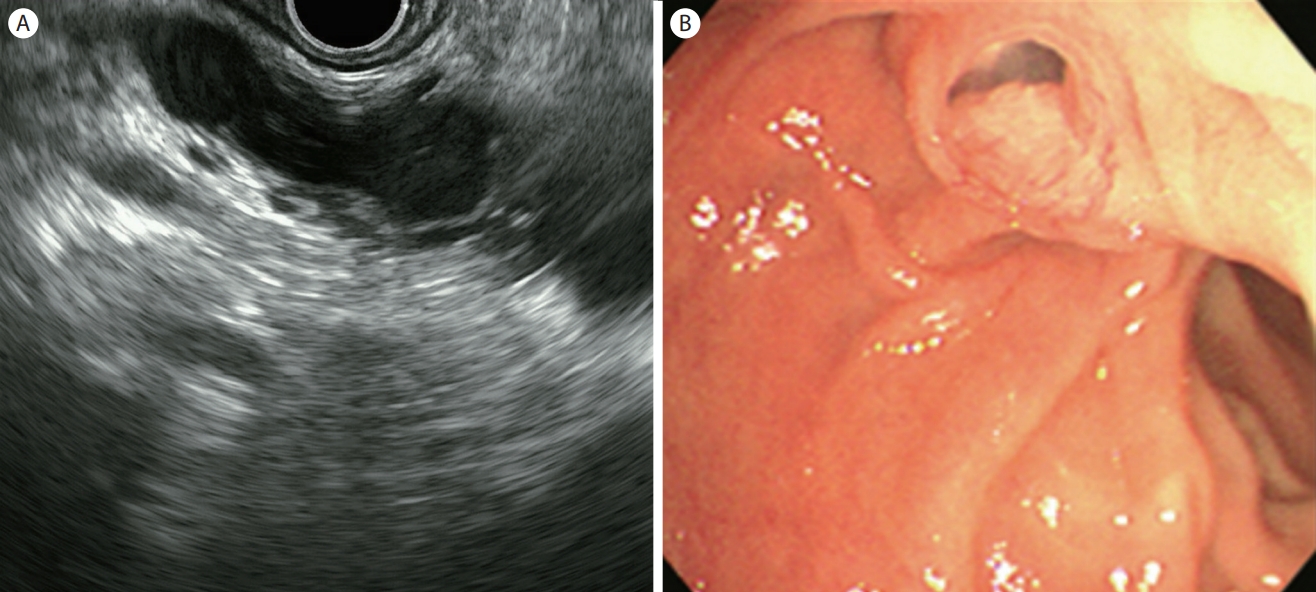
Figure 2.
Endoscopic ultrasound image of branch duct-intraductal papillary mucinous neoplasm. (A) Grape-like appearance of cysts, communicating with each other. (B) Multiseptated cystic lesion with lobulated contour. (C) Multicystic lesion with septa and lobulated contour. 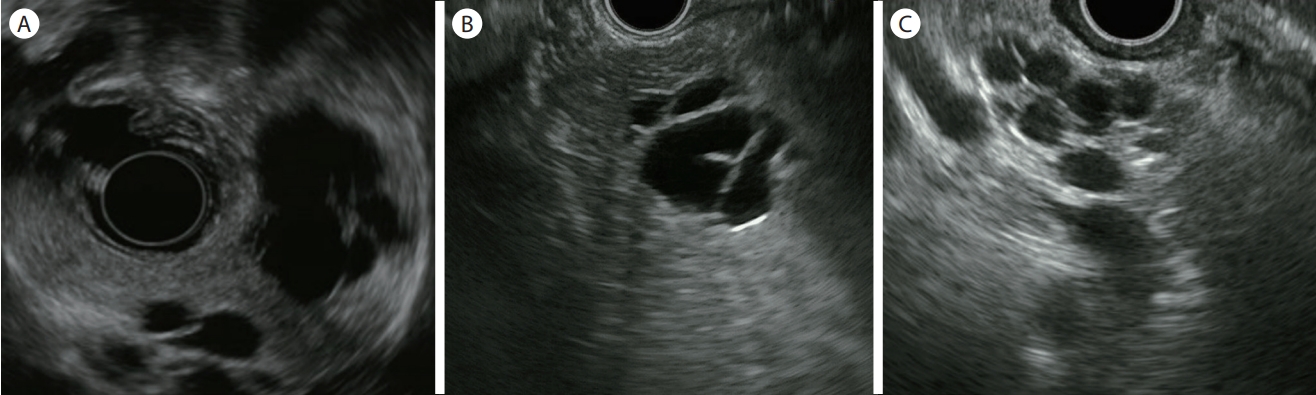
Figure 3.
Endoscopic ultrasound image of mucinous cystic neoplasm. Macrocystic unilocular lesion with fluid-filled, thin-walled, peripheral calcifications. 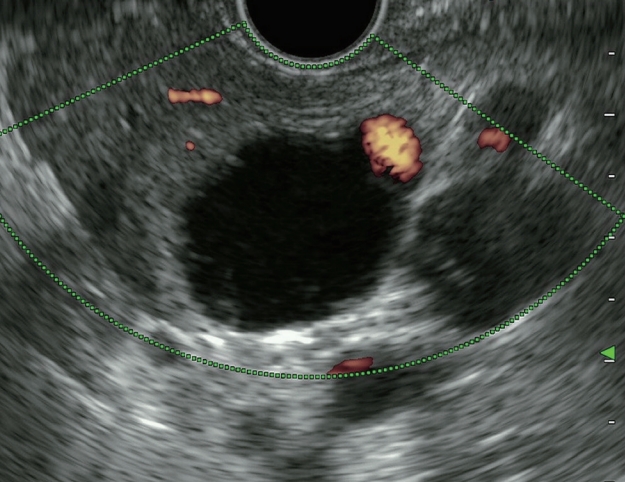
Figure 4.
Endoscopic ultrasound image of serous cystic neoplasm (SCN). (A) Microcystic honeycomb structure with central calcification. (B) Unilocular cystic lesion. (C) Mixed type SCNs consist of micro- and macrocysts. 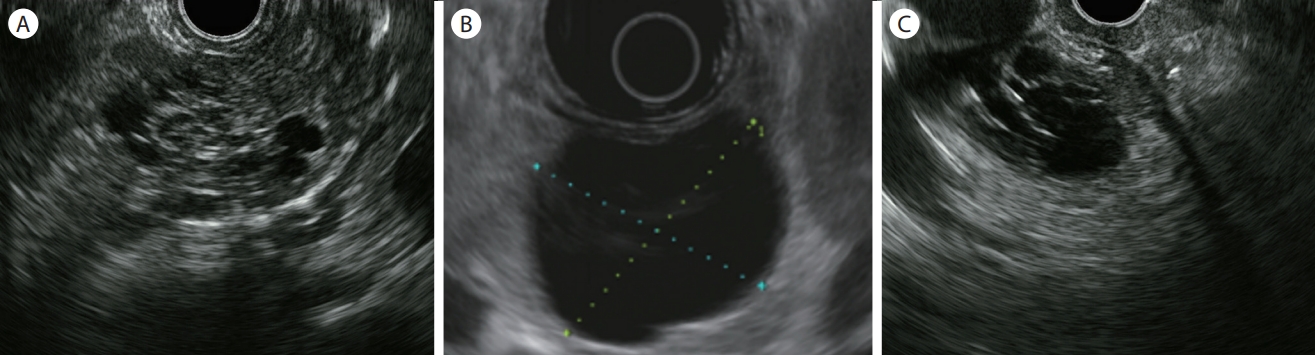
Figure 5.
Endoscopic ultrasound image of solid pseudopapillary neoplasm. (A) A well-defined, hypoechoic solid mass. (B) A hypoechoic solid mass with the small cystic area and internal calcifications. 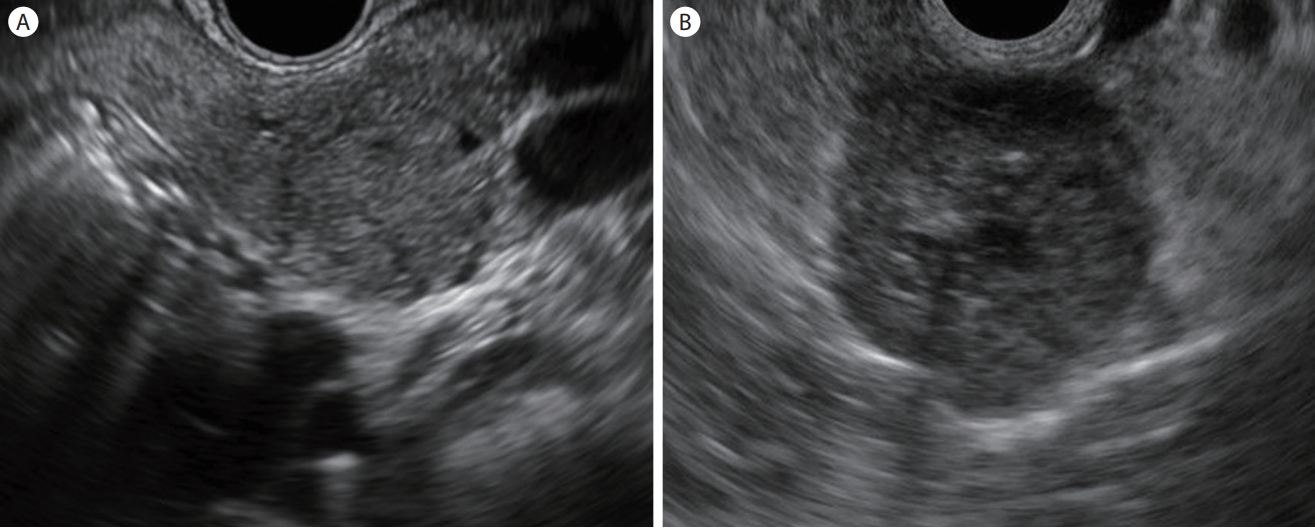
Figure 6.
Endoscopic ultrasound image of a pseudocyst. Large pancreatic pseudocyst with fluid-filled, thick-walled calcifications. 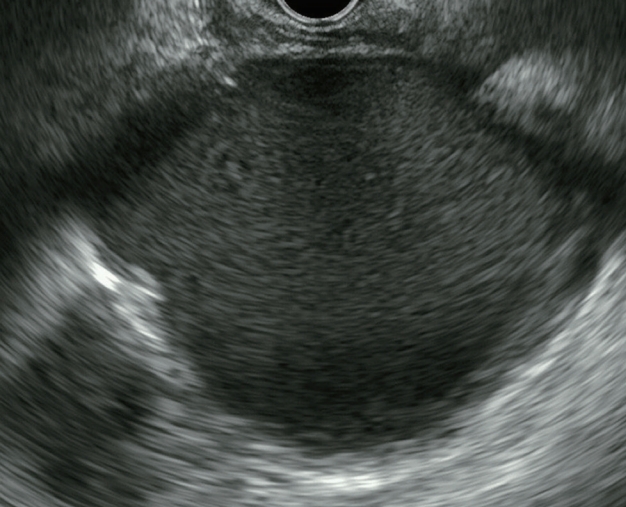
Table 1.
Worrisome features and high-risk stigmata in revised Fukuoka Guidelines
|
Worrisome features |
High-risk stigmata |
|
Cyst ≥ 3 cm |
Obstructive jaundice with cyst in head of pancreas |
|
Enhancing mural nodule < 5 mm |
Enhancing mural nodule ≥ 5 mm |
|
Thickened/enhancing cyst walls |
Main pancreatic duct ≥ 10 mm |
|
Main duct size 5-9 mm |
|
|
Abrupt change in caliber of p-duct with distal pancreatic atrophy |
|
|
Lymphadenopathy |
|
|
Increased serum level of CA19-9 |
|
|
Cyst growth rate ≥ 5 mm/2 years |
|
REFERENCES
1. de Jong K, Nio CY, Hermans JJ, et al. High prevalence of pancreatic cysts detected by screening magnetic resonance imaging examinations. Clin Gastroenterol Hepatol 2010;8:806–811.   3. Scheiman JM, Hwang JH, Moayyedi P. American gastroenterological association technical review on the diagnosis and management of asymptomatic neoplastic pancreatic cysts. Gastroenterology 2015;148:824–848.e22.   4. Curry CA, Eng J, Horton KM, et al. CT of primary cystic pancreatic neoplasms: can CT be used for patient triage and treatment? AJR Am J Roentgenol 2000;175:99–103.  5. Visser BC, Yeh BM, Qayyum A, Way LW, McCulloch CE, Coakley FV. Characterization of cystic pancreatic masses: relative accuracy of CT and MRI. AJR Am J Roentgenol 2007;189:648–656.   7. Kitano M, Sakamoto H, Matsui U, et al. A novel perfusion imaging technique of the pancreas: contrast-enhanced harmonic EUS (with video). Gastrointest Endosc 2008;67:141–150.   8. Ohno E, Hirooka Y, Itoh A, et al. Intraductal papillary mucinous neoplasms of the pancreas: differentiation of malignant and benign tumors by endoscopic ultrasound findings of mural nodules. Ann Surg 2009;249:628–634.  9. Koito K, Namieno T, Nagakawa T, Shyonai T, Hirokawa N, Morita K. Solitary cystic tumor of the pancreas: EUS-pathologic correlation. Gastrointest Endosc 1997;45:268–276.   10. Ahmad NA, Kochman ML, Brensinger C, et al. Interobserver agreement among endosonographers for the diagnosis of neoplastic versus non-neoplastic pancreatic cystic lesions. Gastrointest Endosc 2003;58:59–64.   11. Brugge WR, Lewandrowski K, Lee-Lewandrowski E, et al. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology 2004;126:1330–1336.   12. Gaujoux S, Brennan MF, Gonen M, et al. Cystic lesions of the pancreas: changes in the presentation and management of 1,424 patients at a single institution over a 15-year time period. J Am Coll Surg 2011;212:590–600. discussion 600-603.   13. Sohn TA, Yeo CJ, Cameron JL, et al. Intraductal papillary mucinous neoplasms of the pancreas: an updated experience. Ann Surg 2004;239:788–797. discussion 797-799.   14. Tanaka M, Fernández-Del Castillo C, Kamisawa T, et al. Revisions of international consensus Fukuoka guidelines for the management of IPMN of the pancreas. Pancreatology 2017;17:738–753.   15. Sakorafas GH, Smyrniotis V, Reid-Lombardo KM, Sarr MG. Primary pancreatic cystic neoplasms revisited: part II. Mucinous cystic neoplasms. Surg Oncol 2011;20:e93–e101.   17. Reddy RP, Smyrk TC, Zapiach M, et al. Pancreatic mucinous cystic neoplasm defined by ovarian stroma: demographics, clinical features, and prevalence of cancer. Clin Gastroenterol Hepatol 2004;2:1026–1031.   18. Javadi S, Menias CO, Korivi BR, et al. Pancreatic calcifications and calcified pancreatic masses: pattern recognition approach on CT. AJR Am J Roentgenol 2017;209:77–87.   19. Vege SS, Ziring B, Jain R, Moayyedi P; Clinical Guidelines Committee; American Gastroenterology Association. American gastroenterological association institute guideline on the diagnosis and management of asymptomatic neoplastic pancreatic cysts. Gastroenterology 2015;148:819–822.   21. Jais B, Rebours V, Malleo G, et al. Serous cystic neoplasm of the pancreas: a multinational study of 2622 patients under the auspices of the International Association of Pancreatology and European Pancreatic Club (European Study Group on Cystic Tumors of the Pancreas). Gut 2016;65:305–312.  22. Goh BK, Tan YM, Yap WM, et al. Pancreatic serous oligocystic adenomas: clinicopathologic features and a comparison with serous microcystic adenomas and mucinous cystic neoplasms. World J Surg 2006;30:1553–1559.   23. Menard A, Tomlinson G, Cleary S, Wei A, Gallinger S, Haider MA. Serous cystadenomas of the pancreas: long-term follow-up measurement of growth rate. Can Assoc Radiol J 2011;62:190–196.   24. Fusaroli P, Serrani M, De Giorgio R, et al. Contrast harmonic-endoscopic ultrasound is useful to identify neoplastic features of pancreatic cysts (with videos). Pancreas 2016;45:265–268.   25. Kubo H, Nakamura K, Itaba S, et al. Differential diagnosis of cystic tumors of the pancreas by endoscopic ultrasonography. Endoscopy 2009;41:684–689.   26. Gress F, Gottlieb K, Cummings O, Sherman S, Lehman G. Endoscopic ultrasound characteristics of mucinous cystic neoplasms of the pancreas. Am J Gastroenterol 2000;95:961–965.   27. Ganeshan DM, Paulson E, Tamm EP, Taggart MW, Balachandran A, Bhosale P. Solid pseudo-papillary tumors of the pancreas: current update. Abdom Imaging 2013;38:1373–1382.   30. Chung YE, Kim MJ, Choi JY, et al. Differentiation of benign and malignant solid pseudopapillary neoplasms of the pancreas. J Comput Assist Tomogr 2009;33:689–694.   31. Song MH, Lee SK, Kim MH, et al. EUS in the evaluation of pancreatic cystic lesions. Gastrointest Endosc 2003;57:891–896.  
|
|

















