충수염의 초음파 진단
Abstract
Appendicitis is common cause for acute abdomen. With widespread use of high resolution ultrasonography, it has been widely used to evaluate patients with acute right lower quadrant pain. Ultrasonography is easy to perform, minimally invasive, lacks ionizing radiation, allows dynamic visualization of the abdominal organs and is of lower cost compared with computed tomography. This examination can visualize hypertrophy and disruption of the layered structure of the appendiceal wall, accumulation of purulent fluid, and the presence of a fecalith in the appendix. Significance of ultrasonography in the diagnosis of appendicitis is as follows: firstly, it can help definitely diagnose appendicitis in patients with suspected appendicitis or atypical clinical presentation. Secondly, it can help rule out appendicitis in patients with lower abdominal pain by demonstrating normal appendix. But ultrasonography has some limitations in patients with atypical position of appendix or obesity. So understanding of various ultrasonographic findings of appendicitis and acquisition of ultrasonographic techniques such as position change and graded compression can help reduce false positive and false negative diagnosis of appendicitis.
Keywords: Ultrasonography; Appendix; Appendicitis
중심 단어: 초음파; 충수; 충수염
서 론
급성 충수염은 수술이 필요한 급성 복증의 가장 흔한 원인질환이다[ 1]. 평생 동안 충수염으로 수술할 확률은 약 7% 정도로 알려져 있으며[ 2] 10세에서 19세 사이의 나이, 남자, 백인에서 더 흔하다[ 3]. 급성 복통 환자에서 초음파검사는 소화관의 가스나 뼈에 의해서 음향창이 좋지 않고 복부비만 환자에서 검사가 어렵고, 검사자의 숙련도에 따른 진단율의 차이가 있을 수 있는 단점이 있으나, 비침습적이고, 간편하고, 환자와 대화하면서 압통부위를 실시간으로 검사할 수 있고, 소화관의 연동운동과 혈류분포의 확인이 가능하고, 충수의 벽구조를 알 수 있고, 반복적인 검사가 가능하며 특히 방사선 조사의 위험이 없어 소아와 임산부에게 안전하게 사용할 수 있는 장점이 있어서 1차 검사로서 많이 이용된다. 충수염 진단에 있어서 초음파검사의 의의는 급성 충수염이 의심되거나 비특이적 임상 소견이 있는 환자에서 충수염 진단을 확정하고, 충수 주위 염증의 정도를 파악할 수 있고, 비전형적인 충수의 위치를 찾아낼 수 있으며 하복부 통증 환자에서 정상 충수를 찾음으로써 충수염 진단을 배제하는 것이다[ 4- 6]. 충수염의 초음파 진단은 전형적인 경우 비교적 쉬우나 비전형적인 위치에 있거나 비만 환자에서는 위음성이 증가하므로 다양한 형태의 충수염 소견을 숙지하고 자세변경과 단계적 압박과 같은 소화관 초음파의 기본 수기를 습득하는 것이 무엇보다 중요하다. 본고에서는 충수염의 병태생리, 충수의 초음파 스캔법 그리고 충수염의 다양한 초음파 소견에 대해서 기술하고자 한다.
본 론
충수염의 병태생리
충수염은 충수의 내강이 막힘으로써 일련의 경과를 거치게 된다. 내강이 막히는 원인은 분변이 가장 흔하고, 림프조직의 증식, 이전 바륨검사로 인한 찌꺼기, 채소, 과일 씨, 또는 기생충도 원인이 된다[ 7]. 충수내강이 막히면 닫힌창자폐쇄(closed loop obstruction)가 발생하게 되고 충수내강으로 점액의 분비는 지속되어 충수내강의 확장을 일으켜서 충수 내강압이 지속적으로 증가하게 된다. 이때 내장구심신경(visceral afferent nerve)의 신경말단을 자극함으로써 배꼽 주변의 모호하고 경미한 둔통을 일으킨다[ 8]. 이러한 내강확장은 충수의 연동운동을 증가시킴으로써 내장통 외에 경련통을 유발하기도 한다. 지속적인 내압 상승은 충수벽의 정맥울체를 초래하여 점막 방어가 손상되면서 세균의 침입을 초래하고 염증을 일으키는 화농성 충수염 단계가 된다. 더 진행되어 동맥 공급 장애로 조직허혈을 초래되면 충수의 벽 전체에 괴사와 장막의 삼출물이 일어나게 되는 괴저성 충수염 단계가 된다[ 9].
충수의 초음파 스캔법
충수의 초음파검사를 하기 위해서 먼저 볼록형 저주파 탐촉자(3-5MHz)를 사용하여 전체적인 윤곽을 확인하는데 우상복부에서 우측 신장의 장축영상을 얻은 후 하방으로 이동하여 상행결장의 종단상을 찾고 우하복부까지 이동하면 우측 요근과 만나게 되는 맹장에 도달한다. 여기에서 탐촉자를 횡단면으로 회전하면 좌측에 맹장, 하방에 우측 요근, 상방에 말단회장, 우측에 장골동맥을 관찰할 수 있다[ 10]. 다음으로 고주파 선형 탐촉자(7-12MHz)로 바꾼 후 점진적 압박(graded compression)을 통하여 말단회장내 가스를 밀어내고 탐촉자와 우측 요근 사이의 거리를 좁히면서 우측 요근과 말단회장 사이로 주행하는 충수를 발견할 수 있다[ 10, 11]. 간혹 장 회전이상이나 내장역위 환자에서는 충수위치가 좌하복부, 우상복부 또는 배꼽주변 등 다양한 부위에 위치할 수 있으므로 맹장을 먼저 찾은 후 충수를 찾거나 증상이 있는 환자의 경우 최대 압통부위를 스캔하는 것이 중요하다( Fig. 1). 충수는 말단부의 위치에 따라서 2시 방향으로 향하는 회장전방형(preileal), 3시 방향으로 향하는 회장후방형(postileal), 4-5시 방향으로 향하는 골반형(pelvic), 6-7시 방향으로 향하는 맹장하방형(subcecal), 10-12시 방향으로 향하는 맹장후방형(retrocecal) 등으로 구분한다( Fig. 2) [ 12]. 우리나라의 경우 골반형과 회장후방형이 가장 흔한 위치로 알려져 있어 앙와위 상태에서 우하복부에서 말단회장의 후방과 우측 요근의 앞쪽의 이 부위에서 먼저 충수를 찾아야 충수 발견율을 높일 수 있다. 이 위치에서 충수가 발견되지 않는다면 충수의 위치는 맹장후방형일 가능성이 높으므로 후방압박이나, 좌측 와위로 자세 변경 후 관찰하면 된다. 저자가 203명의 정상인을 대상으로 시행한 연구에 의하면 충수의 위치는 골반형이 55%, 맹장하방형이 20%, 회장후방형이 16%, 맹장후방형이 9%여서 가장 흔한 골반 부위를 먼저 스캔하는 것이 충수 발견율을 높일 수 있었다.
충수염의 초음파 소견
충수의 최대 전후 직경의 증가(increased maximal outer diameter, Fig. 3)
충수의 전후 직경의 계측은 횡단상에서 측정하며 충수전벽의 장막층에서 후벽의 장막층까지의 거리로 정의한다. 정상은 6 mm 이내이고 충수염이 발생하면 중간 정도의 압박 상태에서 최대 전후 직경이 7 mm 이상이다[ 13- 15]. 충수염 진단시 6 mm를 기준점(cutoff value)으로 하면 진단의 민감도 100%, 특이도 68%였고, 7 mm를 기준점으로 할 경우 민감도 94%, 특이도 88%로 알려져 있다[ 16]. 최대 전후 직경이 6 mm에서 7 mm 사이에 속하는 경우에는 색도플러검사에서의 혈류증가시 충수염에 부합하는 소견으로 볼 수 있다.
충수의 최대 벽 두께의 증가(increased maximal mural thickness, Fig. 4)
충수의 전벽 또는 후벽에 점막층에서 장막층까지의 거리로 정의하고 정상에서는 2 mm 이내이다[ 17]. 충수벽 두께가 3 mm 이상으로 증가되는 것이 충수염의 중요한 소견이다[ 1]. 화농성 충수염 상태가 되면 고에코의 점막하층이 염증성 부종으로 인하여 두꺼워지고 저에코의 근육층까지 염증이 파급되어 두꺼워진다. 충수의 기시부에서 말단부위까지 비후된 점막하층의 구조가 유지되는 것이 화농성 충수염의 특징이다[ 18].
점막하층의 소실(focal or global loss of submucosal layer, Fig. 5)
염증반응이 점막하층까지 진행되어 점막하층의 궤양과 괴사가 오게 되면 고에코의 점막하층의 구조가 부분적으로나 전체적으로 소실이 오는데 천공성 충수염에서 더 높은 빈도로 관찰이 된다[ 19].
탐촉자로 압박시 압박되지 않는다(noncompressibility, Fig. 6)
충수염이 발생하면 충수벽의 비후와 충수주변의 지방침착으로 인하여 압박 시에도 직경의 변화가 없는 것이 특징이다[ 14].
색도플러검사상 혈류의 증가(increased vascularity on color doppler, Fig. 7)
색도플러검사에서 충수벽과 충수주변의 지방조직으로 혈류 증가 소견을 관찰할 수 있다. 하지만 괴저성 충수염 상태가 되면 충수벽의 혈류는 감소되거나 거의 관찰이 되지 않으나 충수주변 지방조직으로는 혈류증가를 관찰할 수 있다[ 20, 21].
충수분석(appendicolith, Fig. 8)
급성 충수염의 약 30%에서 충수분석을 관찰할 수 있고 초음파에서는 후방음영을 동반한 고에코성 병변으로 관찰되고 크기, 모양 및 개수가 다양하다[ 22- 25]. 충수분석은 충수내강의 가스 및 분변과 감별이 필요한데 가스음영도 고에코이나 불균질하고 지저분한 후방음영을 보이고 탐촉자로 압박시 모양이 변하는 특징이 있고 분변의 경우 상대적으로 에코가 높지 않고 후방음영을 동반하지 않는다[ 26]. 화농성, 괴저성, 천공성 충수염으로 갈수록 충수분석의 빈도가 높아지게 된다. 만약 충수분석의 위치가 말단부에 위치하게 되면 분석의 원위부에만 충수염이 발생할 수 있다. 천공성 충수염에서는 충수 주변의 농양, 액체저류부위에 충수분석을 관찰할 수도 있다[ 27]. 충수분석이 있으면 충수염의 위험성이 증가하게 되지만 정상인에서도 13%에서 충수분석이 발견되고 무증상 충수분석만으로는 충수염의 진단에 불충분한 소견이며 충수벽 두께의 증가나 충수주변의 염증성 소견과 동반될 때 의미가 있다고 한다[ 28].
충수주변의 고에코성 지방조직(periappendiceal fat infiltration, Fig. 9)
충수염이 발생하게 되면 처음에 충수간막(mesoappendix)에 있는 지방에 염증이 생기게 되고, 점차적으로 맹장주변, 장간막, 대망의 지방조직까지 확산되어 초음파에서 고에코성 충수주위 지방조직으로 관찰되고 색도플러검사에서 혈류증가를 볼 수 있는데 충수주위의 고에코 구조물(periappendiceal hyperechoic structure), 증가된 맹장주위 고에코 병변, 저명한 충수주위의 고에코 병변 등 다양한 이름으로 기술된다[ 20, 29]. 양상은 충수의 한 면에 국한되기도 하고, 충수주위 전체를 둘러싸는 형태 또는 충수주위와 주변 장기주변까지 걸쳐있는 형태로 구분되며 충수염의 심한 정도에 비례해서 그 범위도 증가하고[ 30] 비천공성 충수염의 13-54%, 천공성 충수염의 31-64%의 빈도로 관찰된다[ 30]. 복통 환자의 초음파검사에서 고에코성 지방병변이 관찰되는 경우 반드시 그 주위에 충수염을 포함하여 크론병, 세균성 장염, 허혈성 장염 등의 유무를 확인하여야 한다.
충수주위 농양 소견(periappendiceal abscess, Fig. 10)
천공성 충수염이 발생하게 되면 충수주위에 액체저류와 농양이 관찰된다[ 20, 21].
장간막 림프절 비대 및 맹장벽의 비후(mesenteric lymph node enlargement, cecal wall thickening, Fig. 11)
급성 충수염이 발생하면 반응성으로 주변 장간막 림프절 비대가 관찰되고, 이 림프절은 난원형이고, 에코는 등에코 또는 주변 근육에 비해서 저에코로 보인다. 또한 충수의 염증이 충수간막, 맹장주위로 파급되어서 국소적인 맹장벽 비후를 초래한다[ 20, 21]. 특히 소아에서는 충수염 외에도 급성 회맹장염, 장간막 림프절염에 의해서도 장간막 림프절 비후 및 맹장벽 비후가 동반될 수 있어서 진단에 보조적인 소견으로 볼 수 있겠고, 충수 자체의 염증 소견의 유무가 충수염 진단에 결정적인 역할을 한다[ 20, 21].
병리학적으로 분류한 급성 충수염
급성 카타르성 충수염(acute catarrhal appendicitis, Fig. 12)
여러 가지 원인에 의한 충수 입구의 폐쇄로 충수내강의 점액의 저류가 오고 내강의 압력이 증가되어 림프흐름의 장애가 초래되고 점막면의 미란으로 세균감염이 유발되면서 충수벽의 점막층의 충혈과 부종, 백혈구 침윤 등이 발생하는 상태가 되지만 점막하층과 근육층은 백혈구의 침윤이 없는 상태를 말하는 것으로서 초기 충수염이라고도 한다[ 31- 34]. 하지만 무증상 충수절제표본의 약 1/3에서 이러한 소견이 관찰된다는 보고가 있어[ 35] 대부분의 연구자들은 근육층에 백혈구 침윤이 동반된 경우를 급성 충수염 진단의 근거로 설명한다[ 35]. 초음파검사에서는 충수의 직경은 5-6 mm 정도가 경도이고 충수벽의 층 구조는 유지되며 점막층의 부종이 있으나 점막하층의 비후는 동반되지 않는다[ 36]. 색도플러검사에서 충수벽의 혈류증가가 있거나 충수벽이나 충수주위에 고에코의 지방조직이 증가되어 있다면 진단에 도움을 준다. 초기 충수염의 경우 원인이 소실된다면 저절로 호전되기도 하지만 일부에서는 회복되지 않고 더 진행이 되거나 증상이 반복되면서 만성 충수염의 원인이 되기도 한다[ 35, 36].
급성 화농성 충수염(acute suppurative appendicitis, Fig. 13)
충수의 내강의 폐쇄가 지속되면 점막층의 부종과 충혈이 더욱 심해지면서 정맥순환의 장애가 초래되고 세균감염이 진행되어 호중구가 점막층과 근육층에 현저히 침윤이 되고 충수벽의 전층이 화농성 삼출물로 차고 장막층 밖으로 삼출물이 두껍게 덮이게 되는데 이 시기를 급성 화농성 충수염이라고 한다. 급성 화농성 충수염의 초음파 소견은 불명확한 층 구조, 중증도로 늘어난 충수 직경, 제2층 점막 고유층의 소실 또는 두께의 감소, 고에코의 점막하층 두께의 증가 및 도플러혈류검사에서 충수벽과 충수주위의 혈류증가 등이다[ 35, 36].
급성 괴저성 충수염(acute gangrenous appendicitis, Fig. 14)
화농성 충수염에서 허혈성 변화가 심해져서 동맥혈류의 폐쇄가 초래되어 상대적으로 취약한 충수간막의 반대편 충수벽 전층의 괴저성 궤사가 온 경우를 말하며, 초음파 소견은 고에코 점막하층의 국소적 내지 전층의 단락, 농양을 시사하는 국소적인 액체저류 및 도플러혈류검사에서 충수벽 혈류의 감소 내지 소실이 특징이다[ 35, 36].
다양한 형태의 충수염
노인의 충수염(appendicitis in elderly, Figs. 15 and 16)
최근 노년인구의 증가로 인하여 60세 이상 환자의 충수염은 늘고 있는 추세이며 전체 충수염의 8.3%에서 16.4%로 보고하고 있다[ 37- 40]. 전체 충수염은 여자에 비해서 남자가 빈도가 높으나 노년에서는 여자의 평균 수명이 길어 1:1.1-1:1.67로 여성에서 빈도가 높다고 알려져 있다[ 37- 41]. 비노인에서보다 노인에서는 임상양상이 비특이적인 경우가 많고, 천공, 농양과 같은 합병증의 빈도가 증가하게 되므로 진단에 주의를 요한다[ 42]. 노인의 경우 충수벽의 림프조직의 감소와 섬유화로 인한 협착으로 충수내강의 용적이 감소하므로( Fig. 15) 충수의 폐쇄시 압력증가가 조기에 발생함으로써 충수염의 진행이 빠르고 혈관의 경화에 의해 허혈 상태가 쉽게 초래되며[ 43], 장간막 염증차단기능의 약화, 대망의 기능 저하, 영양부족 등으로 인하여 천공 등과 같은 합병증의 빈도가 증가하게 된다( Fig. 16). 또한 충수의 연동 운동이 감소되어 충수 내로 역류된 분변과 찌꺼기의 배출이 원활하게 되지 않는다[ 44]. 반면에 면역기능감소로 인한 발열과 백혈구증가가 경미하고 복부근육 위축으로 반발압통이 적으며 노화에 의한 신경계의 반응변화로 통증에 대한 인지감소로 인하여 임상양상이 비전형적이어서 진단에 주의를 요한다[ 43, 45- 48].
소아의 충수염(appendicitis in children, Figs. 17 and 18)
충수염은 어느 연령에서나 발생할 수 있지만 대개 10-20대 사이에 빈발하고 2세 이하에서는 비교적 드문 것으로 알려져 있다[ 43, 45, 49, 50]. 소아에서의 급성 복통은 흔하게 볼 수 있고 수술적 치료가 필요 없는 비외과적인 질환과 충수염을 감별하는 것이 중요한데 초음파, 컴퓨터단층촬영(computed tomography, CT) 그리고 점수제(alvarodo score, pediatric appendicitis score)를 적용하여 진단의 정확도를 높이는 시도를 하고 있지만 여전히 음성충수절제술의 빈도가 10-30%로 높은 편이다[ 37, 51]. 소아의 우하복부 통증 시에 급성 회맹장염과의 감별이 중요한데, 이 경우 회맹장부위의 비후와 정상충수를 관찰함으로써 진단할 수 있다( Fig. 17). 특히 성인에 비해서 소아에서는 방사선조사의 위험성이 없고 CT에 버금가는 민감도와 특이도를 가진 초음파검사의 중요성이 부각되고 있다[ 10]. 소아의 충수염은 초기 증상이 복통 이외에 오심 구토, 열, 설사와 같은 비특이적인 증상을 많이 호소하고, 병의 진행이 빠른 특징이 있으며 특히 미취학 아동의 경우 의사표시능력이 떨어져서 초기 진단이 어렵고 지연 진단으로 인한 천공성 충수염의 빈도가 성인에 비해서 높다. 또한 충수벽의 점막층에 있는 림프조직의 발달로 인하여 바이러스 감염시 림프조직의 증식으로 충수의 폐쇄가 쉽게 온다. 해부학적 특성상 충수벽의 섬유조직이 적고 얇아서 충수염의 진행이 빠른 경우가 많고 복강 내의 염증을 국소화하려는 인체 방어능력이 저하되어 있고[ 52- 55], 대망의 발육이 완전하지 못하여서 복막염의 위험성이 증가한다[ 53, 56].
임신 중의 충수염(appendicitis in pregnancy, Fig. 19)
급성 충수염은 임신 중 외과적인 수술의 가장 흔한 질환이며 발생빈도는 분만수 1,500명에서 1,700명당 1명에서 발생하는 것으로 알려져 있고 특히 임신 2기에서 많이 발생한다[ 57, 58]. 임신 중에는 자궁의 크기에 비례해서 맹장의 위치가 평소 위치에 비해서 상승하게 되어 임신 5개월이 되면 배꼽부위까지, 임신 후반기에는 우상복부나 심와부에 위치할 수 있다[ 59]. 임신 중 급성 충수염은 조기 양막파수, 조기 진통 그리고 태아사망과 같은 합병증이 동반될 수 있으므로 조기 진단이 산모 및 태아의 예후 결정에 중요하다[ 59, 60]. 환자가 호소하는 최대 압통부위를 검사하는 것이 중요하고 환자를 좌측 와위로 이동시킨 후 커진 자궁을 이동시켜 충수를 관찰하는 것이 도움이 된다.
2차성 충수염(secondary appendicitis, Fig. 20)
2차성 충수염은 충수의 염증이 충수내강의 폐쇄로 인한 것이 아니고 대장이나 충수주위의 병변으로 인하여 충수주위로 염증이 파급되어 생기는 충수주위염(periappendicitis, serositis)을 말하고, 이는 교감신경성 벽부종(sympathetic mural edema)에 의한 것으로 알려져 있다[ 61]. 내인성과 외인성 2차성 충수염으로 구분하며, 내인성은 충수와 연결된 맹장과 대장의 염증에 의한 것이고(예, 허혈성 장염, 세균성 장염, 위막성 장염 등) 외인성은 담낭, 간, 방광, 난소, 신장 또는 말단회장 등 주변장기의 병변(크론병, 방광염, 담낭염, 에스결장 게실염 등)이 충수로 파급되어 염증을 일으키는 것이다[ 61]. 맹장벽 비후의 양상에 따라서 1차성 충수염과 구분하는데, 1차성 충수염의 경우 맹장벽 비후가 국소적, 비전주성, 비대칭적, 불규칙한 반면 2차성 충수염의 경우 전주성, 대칭적, 규칙적인 비후가 특징이다[ 62]. 그 외에 초음파검사에서 충수의 확장은 두 경우에 모두 있을 수 있으나, 충수벽의 비후와 충수주위 지방침착은 1차성 충수염의 특징적인 소견이다. 색도플러검사에서는 1차성 충수염은 비후된 충수벽 내부로 혈류증가 소견이 있는 반면에 2차성 충수염은 충수의 장막외측에 혈류증가 소견을 관찰할 수 있는 것이 특징적인 소견이다[ 63, 64].
비만 환자의 충수염(appendicitis in obese patient, Fig. 21)
비만 환자에서는 두꺼운 복벽의 지방층에 의해서 음향감쇠가 증가하고 초음파빔의 투과가 감소됨으로써 깊숙한 위치에 있는 충수의 관찰이 힘들다[ 65]. 이 경우 초음파빔의 깊은 침투가 가능한 저주파 탐촉자로 스캔하는 것이 중요하고 하모닉기법을 사용하면 더 좋은 영상을 얻을 수 있다[ 65]. 앙와위에서 잘 관찰되지 않는 경우에는 좌측 와위로 체위 변경을 하면 도움이 되고, 탐촉자로 충분한 압박을 하여 복벽과 충수 사이의 거리를 줄이게 되면 더 좋은 영상을 얻을 수 있다[ 66, 67].
국소 충수염(focal appendicitis, distal appendicitis, Fig. 22)
충수전장의 원위부 1/3 부위에 국한된 염증을 국소 충수염이라고 정의하고 급성 충수염 환자의 5-20%를 차지한다. 이 경우 근위부에는 정상적인 충수의 모양을 보이므로 충수염 진단의 위음성 가능성이 있어 우하복부압통을 호소하는 환자에서는 반드시 맹관으로 끝나는 충수의 말단부위까지 확인하여야 한다[ 68- 70].
천공성 충수염(perforated appendicitis, Fig. 23)
급성 천공성 충수염은 19-36%에서 발생하는 것으로 보고하고 있다[ 71- 74]. 급성 천공성 충수염과 비천공성 충수염의 감별은 중요한데, 천공성 충수염인 경우 수술 직후에 합병증이 발생할 위험성이 증가되기 때문에 응급으로 수술을 시행하지 않고 항생제 투여 같은 보존적 내과 치료나 저명한 농양이 있는 경우 경피적 배액술로 치료한 후에 간헐기 충수절제술을 시행할 수 있다[ 75- 77]. 급성 천공성 충수염 환자에서 수술 전에 천공성 충수염을 정확히 진단하는 것이야말로 이 질환의 높은 이환율과 사망률[ 78] 그리고 수술 방법이나 수술 시기에 영향을 줄 수 있기 때문에 중요하다[ 79, 80]. 고해상력 초음파를 이용한 단계적 압박 초음파는 충수염을 진단하는데 있어서는 유용한 진단 방법이라는 것이 과거의 여러 보고에서 입증되었지만 천공성 충수염을 진단하는데 있어서는 아직까지 논란이 적지 않다[ 81, 82]. 최근 고해상도 초음파를 이용한 연구에서 충수주위 체액저류, 점막하층 전층의 소실, 장막층의 파열, 비대칭적인 충수벽 비후, 10.5 mm 이상의 최대 단면 직경 등이 천공성 충수염을 의심할 수 있는 소견으로 알려졌다[ 30, 83]. 종종 충수주위 농양내부에 후방음영을 동반하는 고에코의 충수분석이 관찰되는 경우도 있다. 초음파검사시에 저주파 탐촉자를 이용하여 깊숙이 위치하는 충수주위 농양이나 체액저류를 놓치지 않는 것이 중요하다.
후맹장 충수염(retrocecal appendicitis, Fig. 24)
우하복부의 우측 요근과 말단회장 사이에서 충수가 관찰되지 않을 때는 맹장후방에 위치한 충수의 가능성을 염두에 두어야 한다. 후맹장 충수염은 임상양상이 우측 옆구리나 우상복부통증을 호소하는 경우가 많고, 초음파검사에서 앙와위에서는 적절한 압박을 하더라도 관찰할 수 없는 경우가 있어서 좌측 와위로 체위변경을 한 후 우측 옆구리를 음향창으로 압박을 하면 맹장 내의 가스를 우회해서 맹장후방의 충수를 관찰할 수 있다[ 67].
자발적으로 회복되는 충수염(spontaneously resolving appendicitis, Fig. 25)
경도의 급성 충수염 환자에서 항생제 치료 유무에 상관없이 복통이 발생한 후 24시간에서 48시간 이내에 저절로 호전되는 경우를 말하며, 그 원인은 부드러운 분석(soft fecalith)이 충수 기시부에 막혀 있다가 저절로 빠져나가거나, 림프조직의 증식으로 인한 폐쇄가 있다가 저절로 호전되는 경우를 일컫는다[ 11, 14, 81, 84- 86]. 초음파 소견은 염증이 있는 충수가 저명하게 관찰되며 추적검사시 점차 충수의 직경이 감소되고 결국 정상으로 회복된다[ 85]. 충수염으로 수술받았던 환자들 중 7-25%에서는 이전에 비슷한 증상을 경험한 병력이 동반되는[ 87- 91] 것으로 알려져 있다. 임상적으로 증상이 회복된 환자 중에서 재발률이 38%로 알려져 있고 시기는 평균 14주였고 70%에서는 1년 이내에 재발되었다. 특히 남성, 충수의 직경이 8 mm 이상 그리고 장간막 림프절 비후가 없었던 군에서는 재발률이 60%로 높아서 이들의 경우 즉각적인 수술을 권유하였다[ 92]. 하지만 증상이 거의 호전된 환자에서 수술을 꺼리는 경우에는 증상이 재발시 즉각적인 병원 내원을 권유하여야 한다.
만성 충수염(chronic appendicitis, Fig. 26)
만성 충수염은 전체 급성 충수염 환자에서 1.5% 빈도로 나타나며[ 93], 충수의 지속적인 불완전한 폐쇄로 인하여 충수에 만성적인 염증 반응을 일으키는 것으로 수주 이상 지속되는 심하지 않은 지속적인 우하복부통증이 특징이다[ 94, 95]. 만성 충수염의 진단은 다른 원인이 없이 3주 이상의 우하복부통증이 있고, 병리학적으로 충수벽의 만성 염증세포 침윤과 충수의 섬유화 소견이 있어야 하고 충 수절제술로서 증 상의 완전한 호전이 있으면 가능하다[ 91, 94- 96].
재발성 충수염(recurrent appendicitis)
재발성 충수염은 2회 이상의 재발되는 급성 충수염으로 정의하는데, 초기 증상은 24-48시간 이내에 저절로 회복되고 각각의 사건 사이에는 증상이 없는 것이 특징이다[ 95].
잔존 충수염(stump appendicitis, Fig. 27)
충수염으로 충수절제술을 시행받았던 환자에서 남아 있던 맹장 기저부위의 충수 절단면에서 재발한 염증으로서 최근에 복강경하 충수절제술이 보편화됨에 따라 충수절제술의 과거력이 있는 환자에서도 우하복부통증의 원인으로 잔존 충수염의 가능성을 염두해 두어야 한다[ 97]. 잔존 충수염의 임상양상은 일반적인 충수염과 동일하다. 다만 충수절제술의 과거력 때문에 진단과정에서 다른 질환을 먼저 생각하는 경우가 있어서 이로 인한 진단의 지연으로 약 70%의 환자에서는 천공 후 발견되는 경우가 많다[ 98, 99]. 복강경 충수절제술 당시에 염증이 심하여 불완전절제를 한 경우나 충수-맹장 접합부를 충분히 확인하지 못하고 수술한 경우, 5 cm 이상의 잔존 충수를 남기는 경우에서 그 빈도가 증가되므로 복강경 충수절제술 시에 충수 기저부를 확인하지 못하는 경우 개복수술로 전환하고 남아있는 충수 기저부가 3 mm를 넘지 않도록 권고하고 있다[ 98, 99]. 진단 방법은 초음파보다는 다중검출 복부 전산화단층촬영(multi-detector computed tomography)을 통한 경우가 더 많았으나[ 100- 102], 최근 고해상도 초음파검사의 도입으로 초음파검사로 진단이 가능하다. 대부분 우하복부의 맹장주위의 염증, 농양, 체액저류, 염증성 종괴 등의 간접적인 소견을 보이고, 잔존 충수의 길이가 충분하지 않은 경우에는 술 전 진단이 어렵다.
충수 게실염(appendiceal diverticulitis, Fig. 28)
충수의 게실염은 충수벽의 게실에서 발생한 염증을 말하는데 빈도는 수술 환자의 0.2-1.5%로 아주 드문 질환이며[ 103] 임상양상이 급성 충수염과 감별이 어려운 경우가 많아서 수술 후 진단되는 경우가 많고 수술 전 초음파로 진단되는 경우는 드물다. 충수염에 비해 발병 연령이 높고, 복통의 지속기간이 긴 편이다[ 104]. 초음파 소견은 정상 충수에 생긴 게실내 저에코성 염증, 게실 입구의 고에코의 분석, 그리고 충수게실주변의 고에코성 염증성 지방조직 등이 있다. 충수게실은 후천적으로 장관내압의 증가로 인해서 충수벽 내로 관통동맥이 들어가는 부위에서 점막과 점막하층이 외벽으로 돌출되는 가성 게실로서 60%에서는 충수의 원위부에서 발생하고 급성충수염에 비해서 천공이 잘되는 것이 특징이다[ 105]. 충수의 게실성 질환은 4가지 형태로 구분하여 기술한 바 있는데[ 106] 이는 1) appendiceal diverticula without inflammation, 2) acute appendicitis with appendiceal diverticula, 3) acute appendiceal diverticulitis with acute appendicitis, 4) acute appendiceal diverticulitis이며 이 중에서 4번째가 진정한 충수 게실염에 해당된다.
우측 결장암에 의한 급성 충수염(acute appendicitis secondary to cecal cancer, Fig. 29)
맹장에서 발생한 악성 종양은 종양 자체에 의한 충수 입구의 폐쇄, 종양의 파급에 의한 충수 외부 압박, 종양의 충수조직으로의 직접 침윤 그리고 종양에 의한 장벽의 천공으로 인한 충수 주위 농양의 형성을 유발할 수 있다[ 107]. 일반적인 충수염과 같이 충수의 종대, 충수주위의 염증성 고에코의 지방조직과 더불어 맹장종양에 의한 맹장벽 비후, 종괴 형성, 림프절 비후 등의 소견을 관찰할 수 있다. 맹장종양에 의한 충수 입구의 폐쇄로 무균의 점액이 고이게 되고 충수의 확장에 비해서 우하복부통증이나 압통이 상대적으로 경미한 경우 또는 50세 이상의 충수염 환자에서 우측 대장암에 의한 2차성 충수염을 의심할 수 있다[ 63, 108].
결 론
충수염은 진단이 늦어질 경우 천공의 합병증이 생길 수 있는 질환으로 환자의 증상 및 이학적인 소견과 함께 초기에 적극적인 초음파검사를 함으로써 진단율을 높일 수 있다. 특히 소화관초음파의 기본원리를 잘 이해하고 계통적인 방법으로 충수를 스캔하는 연습을 꾸준하게 함과 동시에 본고에서 기술한 다양한 충수염의 초음파 소견을 숙지한다면 하복부통증 환자에서 충수염의 진단율을 높일 수 있을 것이다.
Figure 1.
(A) Longitudinal view of ascending colon using high frequency linear probe shows haustration (H) between the air-filled loops (arrows). (B) Longitudinal view of cecum (C) shows semisolid feces filled cecal tip which ends at psoas muscle (P). (C) Transverse view of right iliac fossa. Note heterogenous echogenicity within the cecum (C) which is connected to cecoappendiceal junction (arrows). Also noted appendix (A) lying between terminal ileum (TI) and psoas muscle (P). (D) Longitudinal view of ileocecal valve (arrows) connecting terminal ileum and cecum. Normal appendix. (E) Longitudinal section of normal appendix. Note the appendix (arrows) draping over the iliac vessels and the well-preserved submucosal layer (arrowhead) and acoustic reflection from the collapsed luminal interface (thick arrow). (F) Transverse section of normal appendix shows ovoid shaped appendix (arrows) with normal caliber (3 mm, calipers not shown). H, haustration; C, cecum; TI, terminal ileum; A, appendix; P, psoas muscle; IA, iliac artery. 
Figure 2.
Diagram of position of appendix. T, tenia coli; C, cecum; TI, terminal ileum. 
Figure 3.
Increased maximal outer diameter of appendix: Transverse section (A) and longitudinal section (B) of appendix showed maximal outer diameter of 11.5 mm (calipers). 
Figure 4.
Longitudinal section of appendix demonstrated maximal mural thickness of 4.4 mm (calipers). A, appendix. 
Figure 5.
(A) Transverse section of appendix (A) demonstrated circumferential loss of submucosal layer (arrow). (B) Longitudinal section of appendix (A) showed partial loss of submucosal layer (arrows). A, appendix. 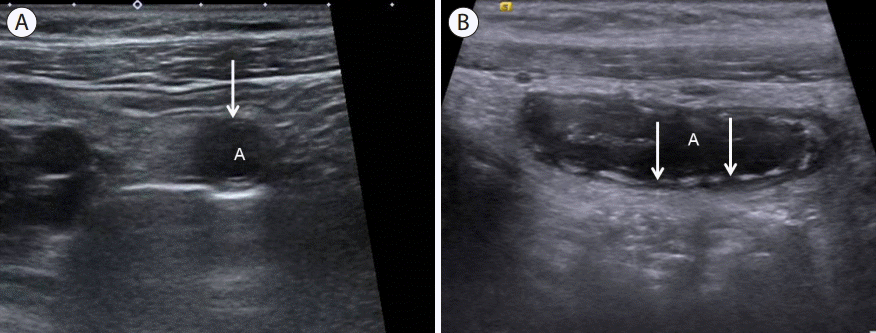
Figure 6.
Dual gray scale compression transverse section of appendix. (A) Before compression, (B) during compression showing uncompressible distended appendix (A). A, appendix. 
Figure 7.
Transverse section of appendix in acute appendicitis with hyperemia of appendiceal wall (long arrow) and mesoappendix (short arrow). A, appendix. 
Figure 8.
Transverse section of appendix showing echogenic appendicolith (arrow) within the lumen of the appendix casting posterior shadowing (arrowheads). 
Figure 9.
Transverse section of appendix showing round distended appendix (A) with increased periappendiceal echogenicity representing fatty infiltration (F). A, appendix; F, periappendiceal fat infiltration. 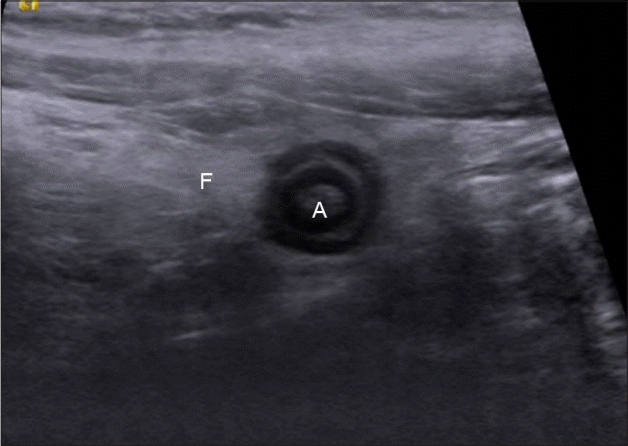
Figure 10.
Transverse section of appendix (A) showing disruption of serosal layer with periappendiceal fluid collection (arrows). F, periappendiceal fat infiltration; A, appendix. 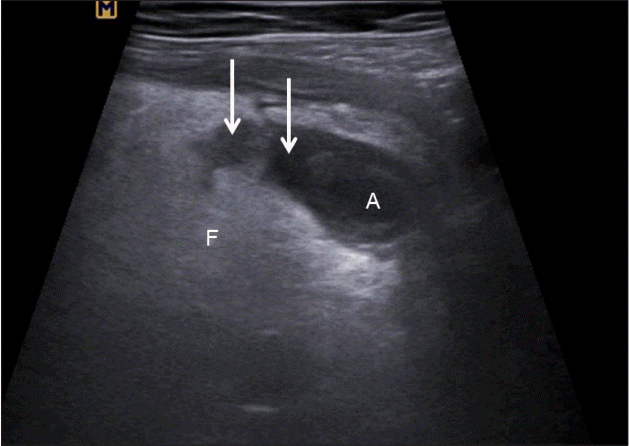
Figure 11.
(A) Transverse scan of right iliac fossa showed mesenteric lymph node enlargement (arrow). (B) Transverse scan of right iliac fossa demonstrating focal cecal wall thickening (arrow). C, cecum. 
Figure 12.
Catarrhal appendicitis in a 22-year old male. (A) Transverse section of appendix demonstrated ovoid configuration (A) mild hyperemia on color doppler study (arrow). (B) Longitudinal section showed mildly distended tubular structure with intraluminal exudates and feces (A). Note no thickening of submucosal layer (short arrow). He complained right lower quadrant pain for 2 days. His WBC count was 15,300 per mm3. He underwent appendectomy which revealed early acute appendicitis. A, appendix; P, psoas muscle; WBC, white blood cell. 
Figure 13.
Suppurative appendicitis in a 35-year old male. (A) Longitudinal section of appendix (A) showed distended tubular structure with thickening of echogenic submucosal layer (arrow). (B) Transverse section of appendix demonstrated noncompressible round inflamed appendix (A) with periappendiceal fatty change. A, appendix. 
Figure 14.
Gangrenous appendicitis in a 27-year old female. (A) Transverse section demonstrated round distended appendix (A) with focal loss of submucosal layer (arrowhead) indicating focal gangrenous change within appendix. Note that anterior aspect of submucosal layer is intact (arrow), indicating no circumferential gangrene of appendix. (B) Longitudinal section of appendix showed tubular distended appendix with loss of echogenic submucosal layer of posterior wall (arrowheads) Note well preserved echogenic submucosal layer of anterior wall (arrows). (C) Color doppler image of longitudinal section of the appendix (A) demonstrating absence of vascularity indicating gangrenous change. A, appendix. 
Figure 15.
A 58-year old male with atrophied appendix. (A) Transverse section of appendix. Note oval shaped appendix with maximal outer diameter of 2 mm and narrow lumen (arrows) between psoas muscle and terminal ileum. (B) Longitudinal section of appendix demonstrating marked obliteration of lumen throughout the entire length (arrows). C, cecum; TI, terminal ileum; P, psoas muscle. 
Figure 16.
A 75-year old female with perforated appendicitis. (A) Transverse view of appendiceal base (arrow, 6 mm in diameter). Note markedly increased echogenicity within the inflamed periappendiceal fat (F). (B) Note anechoic fluid collection indicating abscess (A) inferior to the cecum. (C) Transverse section of appendix (A). Note markedly increased echogenicity of periappendiceal fat (F) surrounding inflamed appendix which showed indistinct wall layers. (D) Transverse view of right iliac fossa showed anechoic fluid collection indicating periappendiceal abscess (A) inferior to the cecum. Also noted increased echogenicity within periappendiceal inflamed fat (F). C, cecum; F, periappendiceal inflamed fat; A, appendix. 
Figure 17.
A 15-year old child with ileocecitis. (A) Long axis image of ileocecal valve (arrows) showed marked wall thickening. Note prominent echogenic submucosal layer (SM). (B) Longitudinal section of appendix (arrows) demonstrated gut-pattern tubular structure, with 2.5 mm wall thickness and 5.2 mm lumen width anterior to iliac vessels on gray-scale ultrasonogram. Note prominent hypoechoic deep mucosal layer which corresponds to lymphoid hyperplasia. (C) Transverse section of appendix showed ovoid configuration with 3 mm lumen width anterior to iliac artery (IA). C, cecum; SM, submucosal layer; TI, terminal ileum; P, psoas muscle; IA, iliac artery. 
Figure 18.
A 11-year old girl with acute appendicitis. Longitudinal section of the appendix showed normal proximal appendix (arrowheads) draping over the iliac vessel (IV) and distended tip of appendix (T). Note two hyperechoic appendicoliths (arrows) with posterior acoustic shadowing. C, cecum; P, psoas muscle; IV, iliac vessel; T, tip of appendix. 
Figure 19.
A 24-year old female with acute appendicitis (pregnancy 16 weeks). (A) Transverse section of appendix showed round distended appendix (calipers, 6.9 mm in diameter). (B) Longitudinal section of appendix showed tubular distended appendix (calipers) with thickened echogenic submucosal layer. 
Figure 20.
A 28-year old female with ileocecitis with secondary appendicitis. (A) Diffuse cecal wall thickening(mainly hypoechoic mucosa [M] and hyperechoic submucosa [SM]). (B) Note wall thickening of terminal ileum (arrow). (C) Transverse section of appendix showed round distended appendix (A) with mild hyperemia at subserosal layer on color doppler study. (D) longitudinal section of appendix demonstrated mildly enlarged appendix (A, 6.5mm in diameter, calipers not shown) without appendiceal wall thickening and periappendiceal fatty change. Note well preserverd wall stratification of the appendix (arrows). SM, submucosa; M, mucosa; A, appendix. 
Figure 21.
A 26-year old obese male (body weight: 115 kg) with suppurative appendicitis. (A) In supine position, appendix was not visualized due to severe obesity. (B) After changing into left lateral decubitus position, distended appendix (arrows) was well visualized. 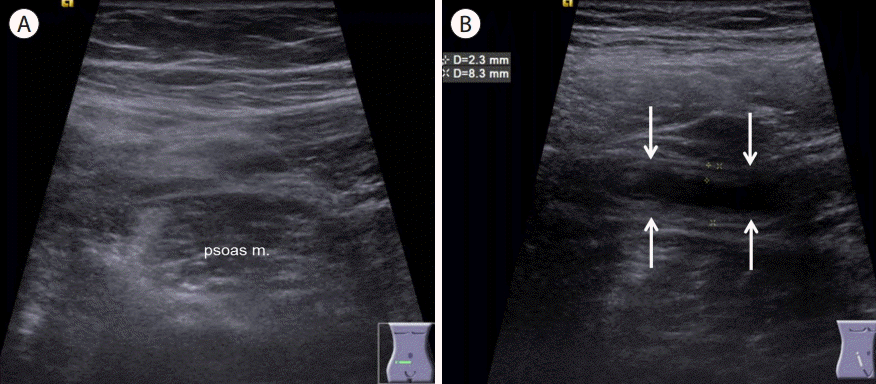
Figure 22.
A 23-year old man with tip appendicitis. Longitudinal section of the appendix showed normal proximal appendix (P, 4.1 mm in width) and distended inflamed tip of appendix(T, 10 mm in width), the last containing appendicolith (long arrow) with posterior acoustic shadowing and partial loss of submucosal layer of tip of appendix (short arrow). P, proximal appendix; IV, iliac vein; T, tip of appendix. 
Figure 23.
(A) A 43-year old male with perforated appendicitis. Longitudinal section of distal appendix demonstrating disruption of serosal layer (long arrow) and periappendiceal abscess (short arrow). (B) A 70-year old female with perforated appendicitis. Longitudinal section of distal appendix demonstrating loss of submucosa of posterior wall of appendix (arrows). (C) A 70-year old female with perforated appendicitis. Transverse section of appendix demonstrating periappendiceal fluid collection (arrow). (D) A 36-year old female with perforated appendicitis demonstrating normal appearing proximal appendix (arrow) with periappendiceal abscess (A). A, appendix. 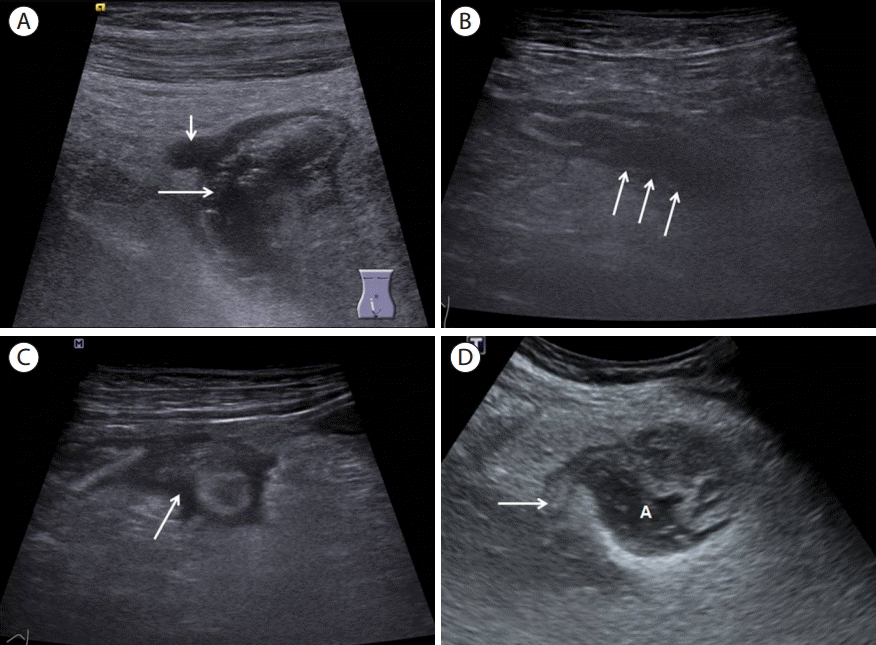
Figure 24.
A 67-year old male with retrocecal appendicitis. Oblique scan of right flank showed longitudinal section of appendix (app). Note the cecoappendiceal junction (short arrow) on the right side and appendiceal tip (long arrow) on the left side of the image which is reversed compared with postileal appendix. 
Figure 25.
A 53-year old male with spontaneously resolving appendicitis. (A) Transverse section of appendix showed round distended with target sign (calipers, maximal outer diameter was 7.8 mm). (B) Longitudinal section of appendix (arrow) demonstrated distended appendix with mildly hyperechoic periappendiceal fatty change. (C) Transverse section of appendix showed hyperemia of appendiceal wall on color doppler study (arrow). Ultrasonographic findings were compatible with acute appendicitis, but symptoms of the patient was nearly improved and he denied right lower quadrant tenderness. So he was suspected of having spontaneously resolving appendicitis and antibiotic therapy was given. (D) On follow-up ultrasonography 3 days later, maximal outer diameter of appendix (calipers) was decreased to 4.8 mm. (E, F) On follow-up after 10 days, maximal outer diameter was further decreased to 4.1 mm (calipers) without recurrence of symptom. Note resolved hyperechoic periappendiceal fat infiltration. 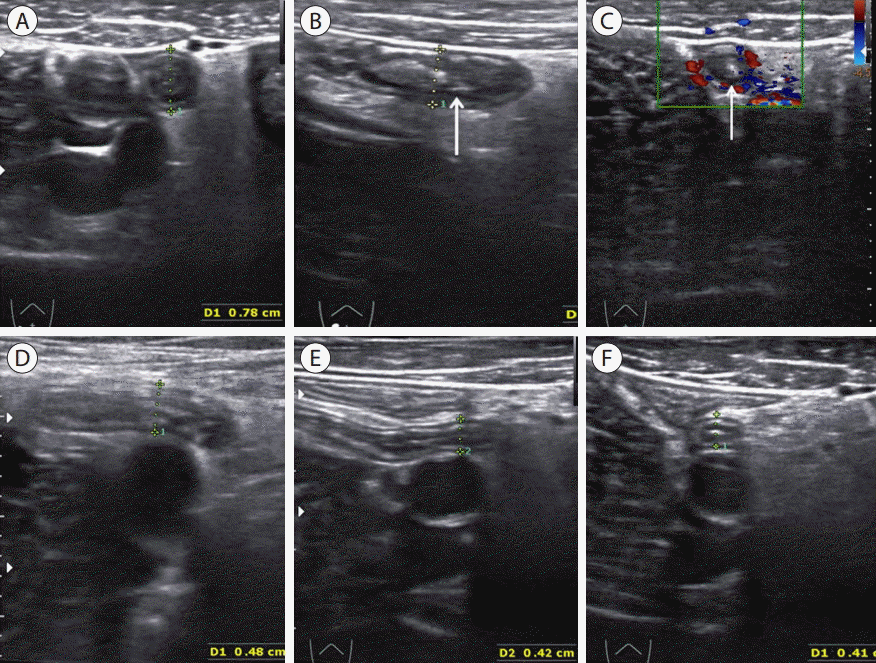
Figure 26.
A 59-year old male with chronic appendicitis. (A) Transverse section of appendix (calipers) showed round distended with maximal outer diameter of 10.2 mm. Note echogenic appendicolith (arrow) with acoustic shadowing. But definite periappendiceal fat infiltration was not identified. (B) Longitudinal section of appendix (calipers) demonstrated distended appendix (calipers) with preserved submucosal layers throughout the entire length of the appendix. (C) Longitudinal color doppler image of appendix (arrow). Note mild intramural hyperemia within the wall of the appendix. He complained chronic right lower quadrant pain for several months. Laparoscopic appendectomy was performed which revealed acute and chronic appendicitis on pathology (not shown). 
Figure 27.
A 23-year old female with stump appendicitis. (A) Transverse view of cecum demonstrates wall thickening, especially echogenic submucosal layer (long arrow). (B) Transverse view of right iliac fossa. Remnant appendix (long arrow) was identified at inferior to the cecum. Also periappendiceal abscess (A) is also observed. (C) Longitudinal view of right iliac fossa. 2.2 x 1.8 cm sized abscess cavity (A) was observed at inferior to the cecum. Note cecal wall thickening (long arrow). A, abscess. 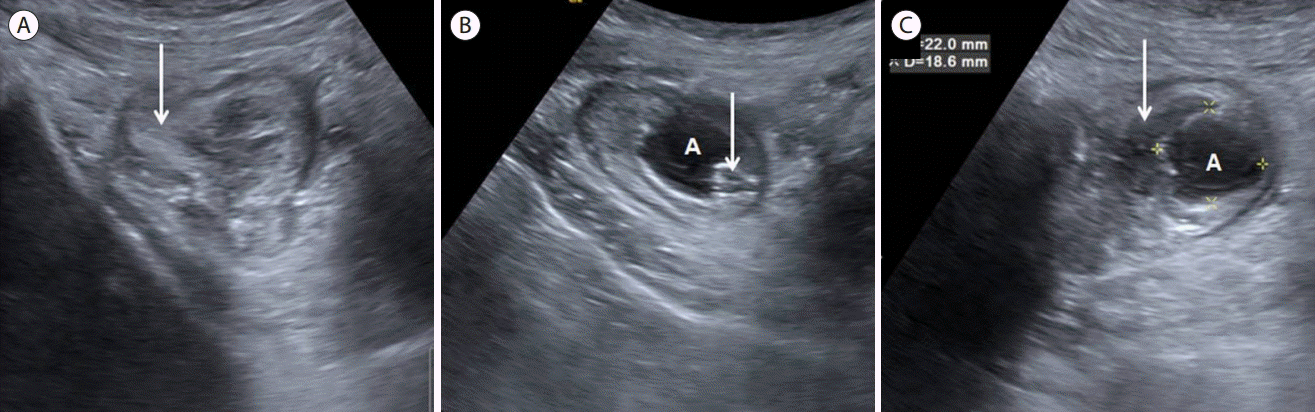
Figure 28.
A 67-year old femle with appendiceal diverticulitis. (A) Longitudinal section of normal proximal appendix. Note the well-preserved submucosal layer (long arrow) (B) Transverse section of distal portion of appendix (long arrow) showed normal caliber with lateral hypoechoic diverticular sac (D). Note peridiverticular hyperechoic fat infiltration (short arrow). (C) On color doppler study of same patient, mildly increased blood flow (arrow) is observed within the wall of appendiceal diverticum (D). D, appendiceal diverticulum. 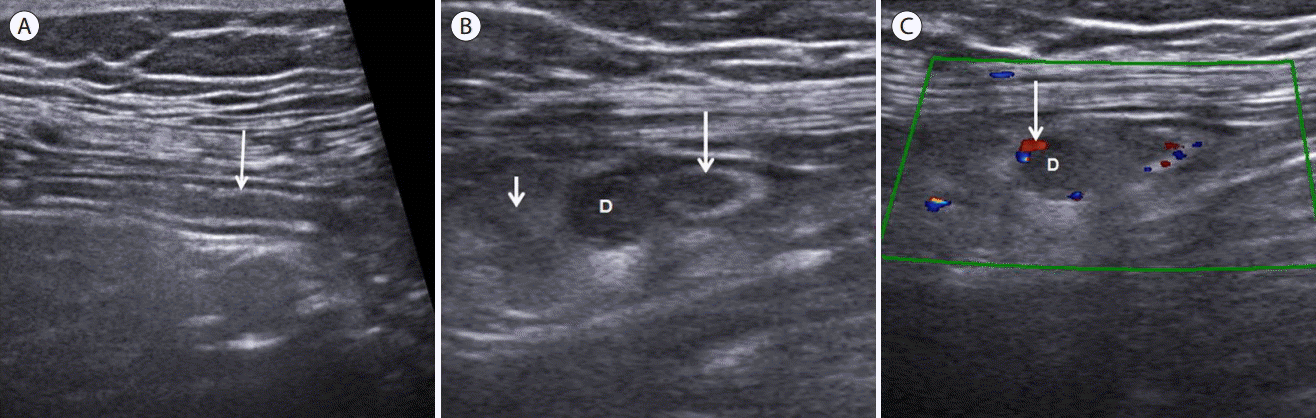
Figure 29.
A 72-year old male with secondary appendicitis due to cecal cancer. (A) Note irregular hypoechoic wall thickening and mass (arrow) of cecum (C) and ileocecal valve (ICV) obstructing appendiceal orifice. (B) Longitudinal section of appendix (long arrows) showed markedly distended appearance with cystic lesion at tip (short arrow). Note irregular hypoechoic mass at cecum invading psoas muscle. ICV, ileocecal valve; C, cecum. 
REFERENCES
1. Neutra RR. Appendicitis: decreasing normal removals without increasing perforations. Med Care 1978;16:956–961.   2. Nelson MJ, Pesola GR. Left lower quadrant pain of unusual case. J Emerg Med 2001;20:241–245.   3. Humes DJ, Simpson J. Acute appendicitis. BMJ 2006;333:530–534.  4. Acheson J, Banerjee J. Management of suspected appendicitis in children. Arch Dis Child Educ Pract Ed 2010;95:9–13.   5. Vignault F, Filiatrault D, Brandt ML, Garel L, Grignon A, Ouimet A. Acute appendicitis in children: evaluationwith US. Radiology 1990;176:501–504.   6. Ang A, Chong NK, Daneman A. Pediatric appendicitis in “real-time”: the value of sonography in diagnosis and treatment. Pediatr Emerg Care 2001;17:334–340.   7. Lamps LW. Appendicitis and infections of the appendix. Semin Diagn Pathol 2004;21:86–97.   8. Lamps LW. Infectious causes of appendicitis. Infect Dis Clin North Am 2010;24:995–1018. ix-x.   9. Williams RA, Myers P. Pathology of the appendix and its surgical treatment. 1st ed. London: Chapman and Hall Medical press, 1994.
11. Puylaert JB. Acute appendicitis: US evaluation using graded compression. Radiology 1986;158:355–360.   12. Oh KJ, Cho JS, Shin KS, et al. Normal appendix in adults: MDCT findings about the location, thickness and the presence or absence of intraluminal gas. J Korean Radiol Soc 2006;55:373–379.  13. Vignault F, Filiatrault D, Brandt ML, Garel L, Grignon A, Ouimet A. Acute appendicitis in children: evaluation with US. Radiology 1990;176:501–504.   14. Rioux M. Sonographic detection of the normal and abnormal appendix. AJR Am J Roentgenol 1992;158:773–778.   15. Goldin AB, Khanna P, Thapa M, McBroom JA, Garrison MM, Parisi MT. Revised ultrasound criteria for appendicitis in children improve diagnositic accuracy. Pediatr Radiol 2011;41:993–999.   16. Rettenbacher T, Hollerweger A, Macheiner P, et al. Outer diameter of the vermiform appendix as a sign of acute appendicitis: evaluation at US. Radiology 2001;218:757–762.   17. Simonovský V. Normal appendix: is there any significant difference in the maximal mural thickness at US between pediatric and adult populations? Radiology 2002;224:333–337.   18. Birnbaum BA, Wilson SR. Appendicitis at the millennium. Radiology 2000;215:337–348.   19. Sivit CJ. Diagnosis of acute appendicitis in children: spectrum of sonographic findings. AJR Am J Roentgenol 1993;161:147–152.   20. Sivit CJ, Siegel MJ, Applegate KE, Newman KD. When appendicitis is suspected in children. Radiographics 2001;21:247–262. questionnaire 288-294.   21. Quillin SP, Siegel MJ. Appendicitis: efficacy of color Doppler sonography. Radiology 1994;191:557–560.   22. Quillin SP, Siegel MJ, Coffin CM. Acute appendicitis in children: value of sonography in detecting perforation. AJR Am J Roentgenol 1992;159:1265–1268.   23. Lowe LH, Penney MW, Scheker LE, et al. Appendicolith revealed on CT in children with suspected appendicitis: how specific is it in the diagnosis of appendicitis? AJR Am J Roentgenol 2000;175:981–984.   24. Rollins MD, Andolsek W, Scaife ER, et al. Prophylactic appendectomy: unnecessary in children with incidental appendicoliths detected by computed tomographic scan. J Pediatr Surg 2010;45:2377–2380.   25. Alaedeen DI, Cook M, Chwals WJ. Appendiceal fecalith is associated with early perforation in pediatric patients. J Pediatr Surg 2008;43:889–892.   26. Ein SH, Langer JC, Daneman A. Nonoperative management of pediatric ruptured appendix with inflammatory mass or abscess: presence of an appendicolith predicts recurrent appendicitis. J Pediatr Surg 2005;40:1612–1615.   27. Singh AK, Hahn PF, Gervais D, Vijayraghavan G, Mueller PR. Dropped appendicolith: CT findings and implications for management. AJR Am J Roentgenol 2008;190:707–711.   28. Huwart L, El Khoury M, Lesavre A, et al. Is appendicolith a reliable sign for acute appendicitis at MDCT? J Radiol 2006;87(4 Pt 1):383–387.   29. Noguchi T, Yoshimitsu K, Yoshida M. Periappendiceal hyperechoic structure on sonography: a sign of severe appendicitis. J Ultrasound Med 2005;24:323–327. quiz 328-330.  30. Blumfield M, Nayak G, Srinivasan R, et al. Ultrasound for differentiation between perforated and nonperforated appendicitis in pediatric patients. AJR Am J Roentgenol 2013;200:957–962.   31. Carr NJ. The pathology of acute appendicitis. Ann Diagn Pathol 2000;4:46–58.   32. Chang AR. An analysis of the pathology of 3003 appendices. Aust N Z J Surg 1981;51:169–178.   33. Dymock RB. Pathological changes in the appendix: a review of 1000 cases. Pathology 1977;9:331–339.   34. Himeno S, Yasuda S, Oida Y, et al. Ultrasonography for the diagnosis of acute appendicitis. Tokai J Exp Clin Med 2003;28:39–44.  36. Ishikawa H. Diagnosis and treatment of acute appendicitis. JMAJ 2003;46:217–221.
37. Lim CY, Ree JK, Jeong YC, Chae KM. A comparative study of the appendicitis in different age groups. J Korean Surg Soc 1988;35:207–214.
38. Hong SK, Kim HS. Clinical review of the acute appendicitis in patients over the age of 60. J Korean Surg Soc 1993;44:449–455.
39. Sim HS, Lee YK, Hwang JY. Acute appendicitis in the aged. J Korean Surg Soc 1998;54:695–700.
40. An SS, Soh YS, Cho IH, Back HM, Lee SY. Clinical analysis of acute appendicitis in the elderly. J Korean Soc Coloproctol 2002;18:274–280.
41. Kim JS, Park SH, Kim CS. Clinical review of the acute appendicitis in patients over the age of 60. J Korean Surg Soc 1989;36:794–803.
42. Kim IG, Heo TG, Lee JM, et al. Clinical analysis of appendicitis in the elderly over 60 years of age. J Korean Soc Coloproctol 2007;23:441–447.  43. Jang SO, Kim BS, Moon DJ. Application of alvarado score in patients with suspected appendicitis. Korean J Gastroenterol 2008;52:27–31.  44. Maxwell JM, Ragland JJ. Appendicitis. Improvements in diagnosis and treatment. Am Surg 1991;57:282–285.  45. Macklin CP, Radcliff GS, Merei JM, Stringer MD. A prospective evaluation of the modified Alvarado score for acute appendicitis in Children. Am R Coll Surg Engl 1997;79:203–205.
46. Lim CY, REE JK, Jeong YC, Chae KM. A comparative study of the appendicitis in different age group. J Korean Surg Soc 1998;35:207–214.
47. Kwon CH, Kim DY, Kim KH, Jung SE, Park KW, Kim WK. Comparison of appendicitis Between Children and Adult. J Korean Soc Coloproctol 1999;57:436–440.
48. Petokallio P, Tykka H. Evolution of the age distribution and mortality of acute appendicitis. Arch Surg 1981;116:153–156.   49. Lee SM, Chang IT, Kim BG, Cha SJ, Kim YJ, Park JS. The efficacy of the Alvarado score in the diagnosis of acute appendicitis. J Korean Soc Coloproctol 2008;24:1–6.  50. Vadeboncoeur TF, Heister RR, Behling CA, Guss DA. Impact of helical computed tomography on the rate of negative appendicitis. AM J Emerge Med 2006;24:43–47.  51. Vissers RJ, Lennarz WB. Pitfalls in appendicitis. Emerg Med Clin North Am 2010;28:103–118. viii.   52. Slattery LR, Yannitelli SA, Hinton JW. Acute appendicitis; evaluation of factors contributing to the decrease in mortality in a municipal hospital over a 20 year period. Arch Surg 1950;60:31–41.   53. Stone HH, Sander SL, Martin JD Jr. Perforated appendicitis in children. Surgery 1971;69:673–679.  54. Yildirim E, Karagülle E, Kirbaş I, et al. Alvarado scores and pain onset in relation to multislice CT finding in acute appendicitis. Diagn Interv Radiol 2008;14:14–18.  55. Kwon CH, Kim DY, Kim KH, Jung SE, Park KW, Kim WK. Comparison of appendicitis between children and adult. J Korean Soc Coloproctol 1999;57:436–440.
56. Graham JM, Pokorny WJ, Harberg FJ. Acute appendicitis in preschool age children. Am J Surg 1980;139:247–250.   57. Mourad J, Elliott JP, Erickson L, Lisboa L. Appendicitis in pregnancy: new information that contradicts long-held clinical beliefs. Am J Obstet Gynecol 2000;182:1027–1029.   58. Gomez A, Wood M. Acute appendicitis during pregnancy. Am J Surg 1979;137:180–183.   59. Seo SW, Kim SK. Acute appendicitis in pregnant patients and non-pregnant patients: recent clinical experience of the tertiary hospital. J Korean Surg Soc 2002;62:486–490.
60. Parangi S, Levine D, Henry A, Isakovich N, Pories S. Surgical gastrointestinal disorders during pregnancy. Am J Surg 2007;193:223–232.   61. Kessler N, Cyteval C, Gallix B, et al. Appendicitis: evaluation of sensitivity, specificity, and predictive values of US, doppler US, and laboratory findings 1. Radiology 2004;230:472–478.   62. Horton KM, Corl FM, Fishman EK. CT evaluation of the colon: inflammatory disease. Radiographics 2000;20:399–418.   63. Pickhardt PJ, Levy AD, Rohrmann CA Jr, Kende AI. Primary neoplasms of the appendix manifesting as acute appendicitis: CT findings with pathologic comparison. Radiology 2002;224:775–781.   64. Rao PM, Wittenberg J, McDowell RK, Rhea JT, Novelline RA. Appendicitis: use of arrowhead sign for diagnosis at CT. Radiology 1997;202:363–366.   65. Benacerraf BR. A technical tip on scanning obese gravidae. Ultrasound Obstet Gynecol 2010;35:615–616.   66. Modica MJ, Kanal KM, Gunn ML. The obese emergency patient: imaging challenges and solutions. Radiographics 2011;31:811–823.   67. Lee JH, Jeong YK, Park KB, Park JK, Jeong AK, Hwang JC. Operator- dependent techniques for graded compression sonography to detect the appendix and diagnose acute appendicitis. AJR Am J Roentgenol 2005;184:91–97.   68. Lim HK, Lee WJ, Lee SJ, Namgung S, Lim JH. Focal appendicitis confined to the tip: diagnosis at US. Radiology 1996;200:799–801.   69. Mazeh H, Epelboym I, Reinherz J, Greenstein AJ, Divino CM. Tip appendicitis: clinical implications and management. Am J Surg 2009;197:211–215.   70. Rao PM, Rhea JT, Novelline RA. Distal appendicitis : CT appearance and diagnosis. Radiology 1997;204:709–712.   71. Addiss DG, Shaffer N, Fowler BS, Tauxe RV. The epidemiology of appendicitis and appendectomy in the United States. Am J Epidemiol 1990;132:910–925.  72. Köner H, Södenaa K, Söeide JA, et al. Incidence of acute nonperforated and perforated appendicitis: age-specific and sex-specific analysis. World J Surg 1997;21:313–317.   73. Al-Omran M, Mamdani M, McLeod RS. Epidemiologic features of acute appendicitis in Ontario, Canada. Can J Surg 2003;46:263–268.   75. Quillin SP, Siegel MJ. Diagnosis of appendiceal abscess in children with acute appendicitis: value of color Doppler sonography. AJR Am J Roentgenol 1995;164:1251–1254.   76. Oliak D, Yamini D, Udani VM, et al. Nonoperative management of perforated appendicitis without periappendiceal mass. Am J Surg 2000;179:177–181.   77. Jeffrey RB Jr, Federle MP, Tolentino CS. Periappendiceal inflammatory masses: CT-directed management and clinical outcome in 70 patients. Radiology 1988;167:13–16.   78. Velanovich V, Satava R. Balancing the normal appendectomy rate with the perforated appendicitis rate: implications for quality assurance. Am Surg 1992;58:264–269.  79. Siewert B, Raptopoulos V, Liu SI, Hodin RA, Davis RB, Rosen MP. CT predictors of failed laparoscopic appendectomy. Radiology 2003;229:415–420.   80. Liu SI, Siewert B, Raptopoulos V, Hodin RA. Factors associated with conversion to laparotomy in patients undergoing laparoscopic appendectomy. J Am Coll Surg 2002;194:298–305.   81. Puylaert JB, Rutgers PH, Lalisang RI, et al. A prospective study of ultrasonography in the diagnosis of appendicitis. N Engl J Med 1987;317:666–669.  82. Borushok KF, Jeffrey RB Jr, Laing FC, Townsend RR. Sonographic diagnosis of perforation in patients with acute appendicitis. AJR Am J Roentgenol 1990;154:275–278.   83. Choi GC. Differentiation of acute perforated from non-perforated appendicitis: usefulness of high-resolution ultrasonography. J Korean Soc Radiol 2011;65:69–76.  84. Jeffrey RB Jr, Laing FC, Townsend RR. Acute appendicitis: sonographic criteria based on 250 cases. Radiology 1988;167:327–329.   85. Migraine S, Atri M, Bret PM, Lough JO, Hinchey JE. Spontaneously resolving acute appendicitis: clinical and sonographic documentation. Radiology 1997;205:55–58.   86. Ooms HW, Koumans RM, Ho Kang You PJ, Puylaert JB. Ultrasonography in the diagnosis of appendicitis. Br J Surg 1991;78:315–318.   87. Barber MD, McLaren J, Rainey JB. Recurrent appendicitis. Br J Surg 1997;84:110–112.   88. Crabbe MM, Norwood SH, Robertson HD, Silva JS. Recurrent and chronic appendicitis. Surg Gynecol Obstet 1986;163:11–13.  89. Ferrier PK. Acute appendicitis in university students: a twenty year study of 1,028 cases. J Am Coll Health Assoc 1972;20:287–290.  90. Lewis FR, Holcroft JW, Boey J, Dunphy E. Appendicitis. A critical review of diagnosis and treatment in 1,000 cases. Arch Surg 1975;110:677–684.   91. Mattei P, Sola JE, Yeo CJ. Chronic and recurrent appendicitis are uncommon entities often misdiagnosed. J Am Coll Surg 1994;178:385–389.  92. Cobben LP, de Van Otterloo AM, Puylaert JB. Spontaneously resolving appendicitis: frequency and natural history in 60 patients. Radiology 2000;215:349–352.   93. Vanwinter JT, Beyer DA. Chronic appendicitis diagnosed preoperatively as an ovarian dermoid. J Pediatr Adolesc Gynecol 2004;17:403–406.   94. Shah SS, Gaffney RR, Dykes TM, Goldstein JP. Chronic appendicitis: an often forgotten cause of recurrent abdominal pain. Am J Med 2013;126:e7–e8.  95. See TC, Watson CJ, Arends MJ, Ng CS. Atypical appendicitis: the impact of CT and its management. J Med Imaging Radiat Oncol 2008;52:140–147.   96. Rao PM, Rhea JT, Novelline RA, Mccabe CJ. The computed tomography appearance of recurrent and chronic appendicitis. Am J Emerg Med 1998;16:26–33.   97. Baek SK, Kim MS, Kim YH, Chung WJ, Kwon JH. A case of stump appendicitis after appendectomy. Korean J Gastroenterol 2008;51:45–47.  98. Liang MK, Lo HG, Marks JL. Stump appendicitis: a comprehensive review of literature. Am Surg 2006;72:162–166.  99. Mangi AA, Berger DL. Stump appendicitis. Am Surg 2000;66:739–741.  100. Baldisserotto M, Cavazzola S, Cavazzola LT, Lopes MH, Mottin CC. Acute edematous stump appendicitis diagnosed preoperatively on sonography. AJR Am J Roentgenol 2000;175:503–504.   101. Aschkenasy MT, Rybicki FJ. Acute appendicitis of the appendiceal stump. J Emerg Med 2005;28:41–43.   102. Shin LK, Halpern D, Weston SR, Meiner EM, Katz DS. Prospective CT diagnosis of stump appendicitis. AJR Am J Roentgenol 2005;184(3 Suppl):S62–S64.  103. Collins DC. A study of 50,000 specimens of the human vermiform appendix. Surg Gynecol Obstet 1955;101:437–445.  104. Place RJ, Simmang CL, Huber PJ Jr. Appendiceal diverticulitis. South Med J 2000;93:76–79.   105. Macheiner P, Hollerweger A, Gritzmann N. Sonographic features of diverticulitis and diverticulosis of the vermiform appendix. J Clin Ultrasound 2002;30:456–457.   106. Lipton S, Estrin J, Glasser I. Diverticular disease of the appendix. Surg Gynecol Obstet 1989;168:13–16.  107. Falco E, Testa T, Celoria G, et al. Acute appendicitis secondary to carcinoma of the right colon. G Chir 1991;12:446–448.  108. Bizer LS. Acute appendicitis is rarely the initial presentation of cecal cancer in the elderly patient. J Surg Oncol 1993;54:45–46.  
|
|








































